Anken là một chủ đề quan trọng trong hóa học hữu cơ. Để nắm vững kiến thức về anken, việc sử dụng sơ đồ tư duy là một phương pháp hiệu quả. Bài viết này sẽ cung cấp một cái nhìn tổng quan về anken, bao gồm đồng đẳng, đồng phân, danh pháp, tính chất vật lý, tính chất hóa học, điều chế và ứng dụng, được trình bày dưới dạng sơ đồ tư duy mở rộng.
I. Khái Niệm và Cấu Tạo
Anken là các hiđrocacbon không no, mạch hở, trong phân tử có chứa một liên kết đôi C=C.
- Công thức tổng quát: CnH2n (n ≥ 2)
- Đồng đẳng: Dãy đồng đẳng của anken bắt đầu từ etilen (C2H4).
- Cấu tạo: Mỗi liên kết đôi gồm một liên kết sigma (σ) và một liên kết pi (π). Các nguyên tử cacbon tham gia liên kết đôi ở trạng thái lai hóa sp2, tạo thành cấu trúc phẳng.
II. Đồng Phân và Danh Pháp
Anken thể hiện tính đa dạng về đồng phân, bao gồm đồng phân cấu tạo và đồng phân hình học.
-
Đồng phân cấu tạo:
- Đồng phân mạch cacbon (từ C4H8 trở lên).
- Đồng phân vị trí liên kết đôi (từ C4H8 trở lên).
-
Đồng phân hình học (cis-trans): Xuất hiện khi mỗi nguyên tử cacbon của liên kết đôi liên kết với hai nhóm thế khác nhau.
- Cis-: Hai nhóm thế giống nhau nằm cùng một phía của liên kết đôi.
- Trans-: Hai nhóm thế giống nhau nằm khác phía của liên kết đôi.
-
Danh pháp:
- Tên thông thường: Sử dụng tiền tố từ ankan tương ứng, thay “an” bằng “ilen” (ví dụ: etilen, propilen).
- Tên thay thế (IUPAC):
- Chọn mạch chính là mạch cacbon dài nhất chứa liên kết đôi.
- Đánh số mạch chính sao cho vị trí liên kết đôi có số nhỏ nhất.
- Tên gọi: Số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – Số chỉ vị trí liên kết đôi – “en”.
III. Tính Chất Vật Lý
Tính chất vật lý của anken biến đổi theo chiều tăng của phân tử khối.
- Trạng thái:
- C2-C4: Khí (ở điều kiện thường).
- C5 trở lên: Lỏng hoặc rắn.
- Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng: Tăng theo chiều tăng của phân tử khối.
- Độ tan: Anken nhẹ hơn và không tan trong nước, tan trong dung môi hữu cơ.
IV. Tính Chất Hóa Học
Liên kết pi (π) trong anken kém bền, làm cho anken dễ tham gia các phản ứng hóa học, đặc biệt là phản ứng cộng.
-
Phản ứng cộng:
-
Cộng hiđro (Hiđro hóa):
CnH2n + H2 → CnH2n+2 (xúc tác Ni, t°)
-
Cộng halogen (Halogen hóa):
CnH2n + X2 → CnH2nX2 (X là Cl, Br)
-
Cộng HX (X là halogen, OH, OSO3H,…): Tuân theo quy tắc Markovnikov.
CnH2n + HX → CnH2n+1X
Quy tắc Markovnikov: Nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn) ở liên kết đôi, còn X cộng vào nguyên tử cacbon bậc cao hơn (có ít H hơn).
-
-
Phản ứng trùng hợp:
- Nhiều phân tử anken kết hợp với nhau tạo thành polime.
- Ví dụ: Trùng hợp etilen tạo thành polietilen (PE).
Alt text: Sơ đồ phản ứng trùng hợp n phân tử anken (etilen) tạo thành polime polietilen, minh họa sự liên kết các mắt xích CH2-CH2 lặp đi lặp lại. Sơ đồ này giúp hình dung rõ hơn về quá trình tạo ra polime từ các monome anken.
-
Phản ứng oxi hóa:
-
Oxi hóa hoàn toàn (Đốt cháy):
CnH2n + O2 → nCO2 + nH2O (nCO2 = nH2O)
-
Oxi hóa không hoàn toàn:
Anken làm mất màu dung dịch KMnO4.
Phản ứng này dùng để nhận biết anken.3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2MnO2 + 2KOH
-
V. Điều Chế Anken
Có nhiều phương pháp điều chế anken, tùy thuộc vào điều kiện phòng thí nghiệm hay công nghiệp.
-
Trong phòng thí nghiệm:
-
Dehidrat hóa ancol:
C2H5OH → C2H4 + H2O (xúc tác H2SO4 đặc, t°)
Phản ứng tách nước từ ancol tạo thành anken.
-
Alt text: Phương trình phản ứng điều chế etilen (C2H4) từ etanol (C2H5OH) sử dụng xúc tác axit sulfuric đậm đặc và nhiệt độ cao trong phòng thí nghiệm, kèm theo sự tách loại một phân tử nước (H2O).
-
Trong công nghiệp:
-
Cracking ankan:
Ankan mạch dài bị bẻ gãy mạch tạo thành anken và ankan mạch ngắn hơn.
-
Dehiđro hóa ankan:
Tách hiđro từ ankan tạo thành anken.
-
Alt text: Các phương pháp điều chế anken trong công nghiệp: Cracking (bẻ gãy mạch) ankan mạch dài thành anken và ankan ngắn hơn, và dehiđro hóa (tách hydro) từ ankan để tạo thành anken.
VI. Ứng Dụng Của Anken
Anken có nhiều ứng dụng quan trọng trong công nghiệp và đời sống.
- Sản xuất polime: Etilen và propilen được trùng hợp để tạo ra các polime như polietilen (PE) và polipropilen (PP), dùng để sản xuất màng mỏng, ống dẫn nước, bình chứa.
- Tổng hợp hóa chất hữu cơ: Etilen được dùng để tổng hợp etanol, etilen oxit, etylen glicol, anđehit axetic.
- Sản xuất các monome khác: Chuyển hóa etilen thành các monome khác để tổng hợp polime.
VII. Sơ Đồ Tư Duy Tổng Quát về Anken
Sơ đồ tư duy dưới đây tóm tắt các kiến thức quan trọng về anken:
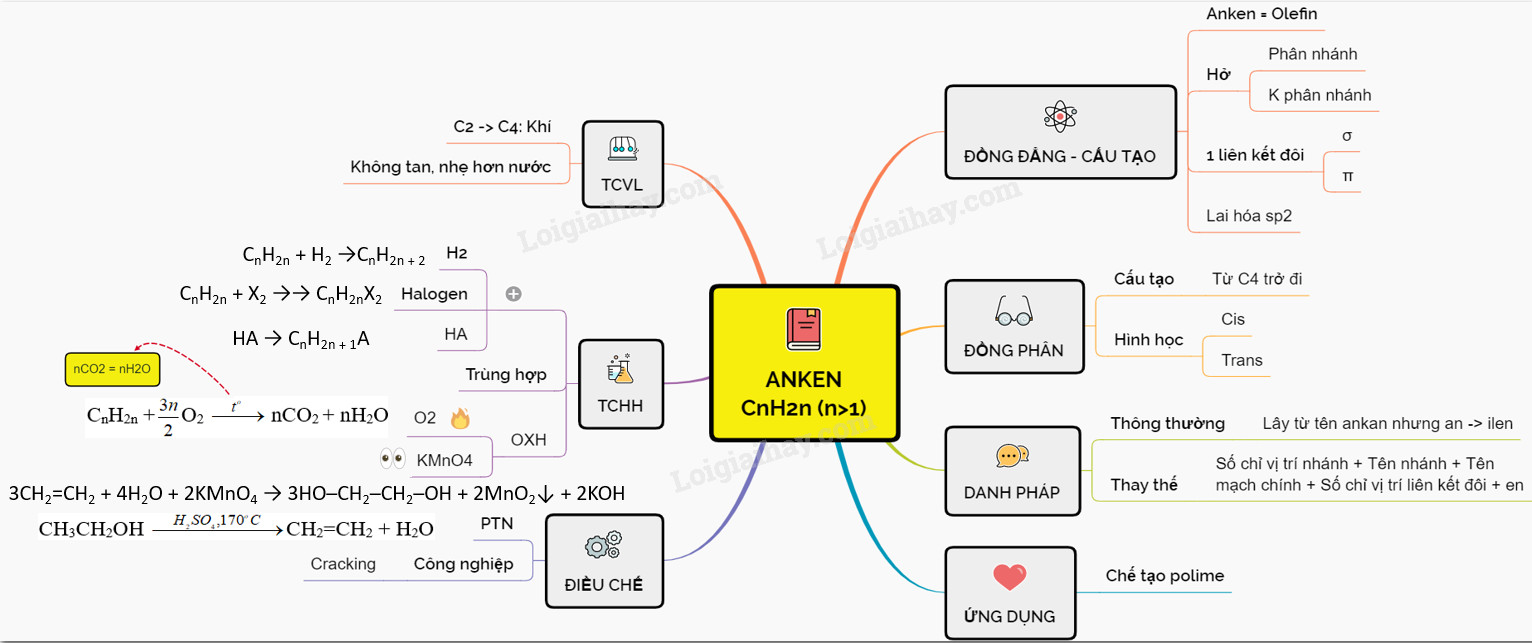 Sơ đồ tư duy tổng quan về anken, bao gồm định nghĩa, tính chất, điều chế và ứng dụng
Sơ đồ tư duy tổng quan về anken, bao gồm định nghĩa, tính chất, điều chế và ứng dụng
Sơ đồ tư duy này giúp hệ thống hóa kiến thức, dễ dàng ghi nhớ và ôn tập về anken. Việc nắm vững sơ đồ tư duy này sẽ giúp học sinh và sinh viên hiểu sâu sắc hơn về anken và các ứng dụng của chúng trong hóa học và đời sống.
