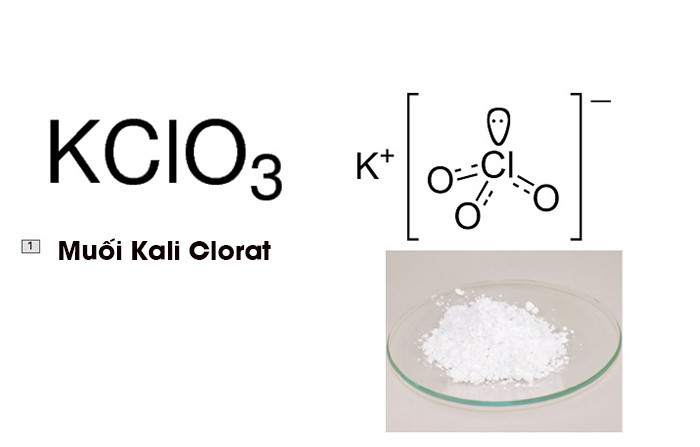
Kali Clorat (KClO3) là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp và phòng thí nghiệm. Đặc biệt, phản ứng nhiệt phân KClO3 là một thí nghiệm quen thuộc trong chương trình hóa học phổ thông. Bài viết này sẽ đi sâu vào phản ứng nhiệt phân KClO3, các yếu tố ảnh hưởng và ứng dụng thực tế của nó.
1. Tổng Quan Về Kali Clorat (KClO3)
KClO3 là một chất rắn tinh thể màu trắng, tan được trong nước nóng và ít tan trong nước lạnh. Nó là một chất oxy hóa mạnh và có thể phản ứng với nhiều kim loại và phi kim.
Tinh thể Kali Clorat (KClO3) màu trắng
Kali Clorat được sử dụng rộng rãi trong sản xuất pháo hoa, thuốc nổ, diêm và làm chất oxy hóa trong nhiều quá trình công nghiệp.
2. Phản Ứng Nhiệt Phân KClO3
Phản ứng nhiệt phân KClO3 là quá trình phân hủy KClO3 dưới tác dụng của nhiệt độ cao. Phản ứng này có thể xảy ra theo hai hướng khác nhau, tùy thuộc vào điều kiện phản ứng.
2.1. Nhiệt Phân KClO3 Không Có Xúc Tác
Ở nhiệt độ khoảng 400°C, KClO3 phân hủy thành Kali Perclorat (KClO4) và Kali Clorua (KCl):
4KClO3 → 3KClO4 + KCl2.2. Nhiệt Phân KClO3 Có Xúc Tác MnO2
Khi có mặt chất xúc tác Mangan đioxit (MnO2) và nhiệt độ khoảng 200°C, KClO3 phân hủy thành Kali Clorua (KCl) và khí Oxi (O2):
2KClO3 → 2KCl + 3O2Đây là phương pháp phổ biến để điều chế khí Oxi trong phòng thí nghiệm. MnO2 đóng vai trò là chất xúc tác, giúp giảm nhiệt độ cần thiết để phản ứng xảy ra và tăng tốc độ phản ứng.
Sơ đồ điều chế Oxi bằng nhiệt phân KClO3
Cơ chế phản ứng khi có MnO2:
MnO2 không tham gia trực tiếp vào phản ứng, nhưng nó cung cấp một bề mặt để KClO3 hấp phụ và phân hủy dễ dàng hơn. Các ion ClO3- trên bề mặt MnO2 bị yếu đi liên kết, làm giảm năng lượng hoạt hóa của phản ứng và cho phép phản ứng xảy ra ở nhiệt độ thấp hơn.
3. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Nhiệt Phân KClO3
- Nhiệt độ: Nhiệt độ càng cao, tốc độ phản ứng càng nhanh.
- Chất xúc tác: MnO2 làm giảm nhiệt độ cần thiết để phản ứng xảy ra và tăng tốc độ phản ứng.
- Kích thước hạt KClO3: KClO3 dạng bột mịn sẽ phản ứng nhanh hơn so với KClO3 dạng tinh thể lớn.
- Áp suất: Áp suất không ảnh hưởng đáng kể đến phản ứng nhiệt phân KClO3.
4. Ứng Dụng Của Phản Ứng Nhiệt Phân KClO3
- Điều chế khí Oxi trong phòng thí nghiệm: Đây là ứng dụng phổ biến nhất của phản ứng nhiệt phân KClO3.
- Sản xuất pháo hoa và thuốc nổ: KClO3 là một thành phần quan trọng trong pháo hoa và thuốc nổ, cung cấp oxy để đốt cháy các chất khác.
Kali Clorat trong đầu que diêm
- Sản xuất diêm: KClO3 được sử dụng trong đầu que diêm, giúp diêm dễ bắt lửa.
- Chất oxy hóa trong công nghiệp: KClO3 được sử dụng làm chất oxy hóa trong nhiều quá trình công nghiệp khác nhau.
5. Bài Tập Về Phản Ứng Nhiệt Phân KClO3
Bài 1: Nung 24.5 gam KClO3 đến khi phản ứng hoàn toàn, thu được bao nhiêu lít khí O2 (đktc)?
Lời giải:
- Số mol KClO3: n(KClO3) = 24.5 / 122.5 = 0.2 mol
- Phương trình phản ứng: 2KClO3 → 2KCl + 3O2
- Số mol O2: n(O2) = (3/2) n(KClO3) = (3/2) 0.2 = 0.3 mol
- Thể tích O2 (đktc): V(O2) = 0.3 * 22.4 = 6.72 lít
Bài 2: Nhiệt phân hoàn toàn 12.25 gam KClO3 có xúc tác MnO2. Tính khối lượng KCl thu được.
Lời giải:
- Số mol KClO3: n(KClO3) = 12.25 / 122.5 = 0.1 mol
- Phương trình phản ứng: 2KClO3 → 2KCl + 3O2
- Số mol KCl: n(KCl) = n(KClO3) = 0.1 mol
- Khối lượng KCl: m(KCl) = 0.1 * 74.5 = 7.45 gam
Nung KClO3 thu O2 và KCl
6. Lưu Ý Khi Sử Dụng KClO3
KClO3 là một chất oxy hóa mạnh và có thể gây nổ khi tiếp xúc với các chất dễ cháy. Cần tuân thủ các biện pháp an toàn sau khi làm việc với KClO3:
- Sử dụng KClO3 trong khu vực thông gió tốt.
- Đeo kính bảo hộ và găng tay khi làm việc với KClO3.
- Không để KClO3 tiếp xúc với các chất dễ cháy.
- Bảo quản KClO3 ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt.
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về phản ứng nhiệt phân KClO3 và các ứng dụng của nó.