Clo (Cl) là một nguyên tố hóa học quan trọng với nhiều ứng dụng trong công nghiệp và đời sống. Bài viết này sẽ cung cấp một cái nhìn toàn diện về hóa trị của clo, tính chất lý hóa, ứng dụng và các khía cạnh liên quan khác.
1. Clo Là Gì? Hóa Trị Của Cl Là Bao Nhiêu?
Clo là một nguyên tố phi kim thuộc nhóm Halogen, ký hiệu là Cl và số hiệu nguyên tử là 17. Trong bảng tuần hoàn, Clo nằm ở chu kỳ 3, ô số 17.
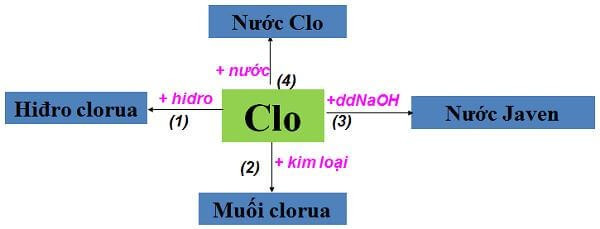
Trong hợp chất, Clo thường có hóa trị I. Ở trạng thái tự do, Clo tồn tại dưới dạng phân tử Cl2. Phân tử Clo nặng hơn không khí.
2. Tính Chất Vật Lý Của Clo
Để hiểu rõ hơn về Clo, ngoài việc nắm vững hóa trị của Cl, chúng ta cần tìm hiểu về các tính chất vật lý đặc trưng của nguyên tố này:
- Ở điều kiện thường, Clo là chất khí màu vàng lục, có mùi hắc, tương tự như brom, và rất độc.
- Khối lượng phân tử của Clo (Cl2) là 71, nặng hơn không khí.
- Clo tan được trong nước và các dung môi hữu cơ.
- Trong tự nhiên, Clo tồn tại chủ yếu ở dạng hợp chất muối clorua như NaCl, KCl và các khoáng vật như cacnalit, xinfinit.
3. Khí Clo Độc Hại Như Thế Nào?
Khí Clo là một chất độc, gây kích ứng mạnh đến hệ hô hấp, đặc biệt đối với trẻ em và người lớn tuổi. Clo ở dạng khí gây kích ứng màng nhầy, còn ở dạng lỏng có thể gây bỏng da. Khi hít phải nồng độ cao, Clo có thể gây phù phổi, tích tụ huyết thanh trong phổi và thậm chí tử vong. Tiếp xúc lâu dài với nồng độ thấp có thể dẫn đến suy yếu phổi và các vấn đề hô hấp khác.
4. Tính Chất Hóa Học Của Clo
Clo là một chất oxi hóa mạnh. Trong các hợp chất, số oxi hóa phổ biến của Clo là -1. Tuy nhiên, Clo cũng có thể có các số oxi hóa khác như +1, +3, +5, +7. Trong một số phản ứng, đặc biệt khi tác dụng với Oxi, Clo thể hiện tính khử.
4.1. Clo Tác Dụng Với Phi Kim
Clo phản ứng với nhiều phi kim khác nhau dưới điều kiện nhiệt độ hoặc ánh sáng:
- Cl2 + 2S → S2Cl2
- H2 + Cl2 → 2HCl (điều kiện: ánh sáng)
- 2P + 3Cl2 → 2PCl3 (điều kiện: nhiệt độ cao)
Lưu ý: Clo không phản ứng trực tiếp với O2.
4.2. Clo Tác Dụng Với Kim Loại
Tương tự như các phi kim khác, Clo tác dụng với kim loại tạo thành muối halogenua (ví dụ: clorua).
- 2Fe + 3Cl2 → 2FeCl3
- 2Na + Cl2 → 2NaCl
Hầu hết các kim loại (trừ Pt và Au) đều phản ứng với Clo.
4.3. Clo Tác Dụng Với Chất Khử Mạnh
Clo có thể oxi hóa các chất khử mạnh:
- 3Cl2 + 2NH3 → N2 + 6HCl
- 4Cl2 + 4H2O + H2S → H2SO4 + 8HCl
Trong phòng thí nghiệm, NH3 thường được sử dụng để khử độc khí Cl2.
4.4. Clo Tác Dụng Với Nước
Clo phản ứng với nước tạo thành dung dịch có tính axit:
Cl2 + H2O ⇔ HCl + HClO
Dung dịch Clo có màu vàng nhạt và mùi hắc. Axit hipoclorơ (HClO) có tính oxi hóa mạnh, làm mất màu quỳ tím.
4.5. Clo Tác Dụng Với Dung Dịch NaOH
Clo có hóa trị I khi tác dụng với dung dịch NaOH, tạo thành nước Gia-ven:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Gia-ven có tính tẩy màu mạnh do chứa NaClO.
4.6. Phản Ứng Cộng, Thế, Phân Hủy
Clo có thể tham gia vào các phản ứng cộng, thế và phân hủy với các hợp chất hữu cơ:
- C2H2 + Cl2 → 2C + 2HCl (phân hủy)
- CH4 + Cl2 → CH3Cl + HCl (thế)
- C2H4 + Cl2 → CH2Cl – CH2Cl (cộng)
5. Ứng Dụng Của Clo
Clo có nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau:
- Tẩy trắng giấy, vải sợi.
- Xử lý nước thải và khử trùng nước sinh hoạt.
- Sản xuất các hợp chất hữu cơ và vô cơ.
6. Điều Chế Clo
Có hai phương pháp chính để điều chế Clo: trong phòng thí nghiệm và trong công nghiệp.
6.1. Điều Chế Clo Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, Clo được điều chế bằng cách cho axit HCl tác dụng với các chất oxi hóa mạnh như KMnO4 hoặc MnO2:
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
6.2. Điều Chế Clo Trong Công Nghiệp
Trong công nghiệp, Clo được sản xuất chủ yếu bằng phương pháp điện phân dung dịch NaCl bão hòa (có màng ngăn):
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Phương pháp này hiệu quả và kinh tế hơn so với các phương pháp khác.
Hy vọng bài viết này đã cung cấp cho bạn đầy đủ thông tin về hóa trị của Clo, tính chất, ứng dụng và phương pháp điều chế Clo.