Phản ứng biến đổi ethanol (C2H6O) thành ethene (C2H4) là một trong những phản ứng quan trọng trong hóa học hữu cơ, đặc biệt trong công nghiệp hóa dầu. Quá trình này thường được thực hiện thông qua phản ứng loại nước (dehydration) từ ethanol. Bài viết này sẽ đi sâu vào các phương pháp thực hiện phản ứng này, cơ chế phản ứng, và các ứng dụng quan trọng của nó.
Phương Pháp Thực Hiện Phản Ứng C2H6O ra C2H4
Phản ứng loại nước từ ethanol để tạo thành ethene có thể được thực hiện bằng nhiều phương pháp khác nhau, nhưng phổ biến nhất là sử dụng xúc tác axit.
1. Sử Dụng Xúc Tác Axit
Xúc tác axit, chẳng hạn như axit sulfuric (H2SO4) đậm đặc hoặc oxit nhôm (Al2O3), thường được sử dụng để xúc tác phản ứng loại nước từ ethanol. Quá trình này thường được thực hiện ở nhiệt độ cao, thường là trên 150°C.
Phương trình phản ứng:
CH3CH2OH --[H2SO4, nhiệt độ]--> CH2=CH2 + H2O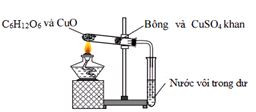 Phản ứng loại nước từ ethanol tạo ethene với xúc tác axit sulfuric
Phản ứng loại nước từ ethanol tạo ethene với xúc tác axit sulfuric
Phản ứng loại nước từ ethanol tạo ethene với xúc tác axit sulfuric, minh họa quá trình chuyển đổi và sản phẩm tạo thành.
Cơ chế phản ứng:
- Proton hóa ethanol: Axit proton hóa nhóm hydroxyl (-OH) của ethanol, tạo thành ion ethyloxonium.
- Loại nước: Ion ethyloxonium mất một phân tử nước (H2O), tạo thành carbocation.
- Tách proton: Carbocation mất một proton (H+) từ một nguyên tử carbon lân cận, tạo thành ethene (CH2=CH2).
2. Sử Dụng Xúc Tác Oxit Kim Loại
Một phương pháp khác là sử dụng các oxit kim loại như Al2O3 làm chất xúc tác. Trong trường hợp này, ethanol được cho đi qua một cột chứa Al2O3 được nung nóng.
Ưu điểm của phương pháp này:
- Hiệu quả: Phản ứng xảy ra với hiệu suất cao.
- Dễ thực hiện: Quá trình tương đối đơn giản và dễ kiểm soát.
Các Yếu Tố Ảnh Hưởng Đến Hiệu Suất Phản Ứng
Hiệu suất của phản ứng chuyển đổi ethanol thành ethene phụ thuộc vào nhiều yếu tố, bao gồm:
- Nhiệt độ: Nhiệt độ cao hơn thường làm tăng tốc độ phản ứng, nhưng nhiệt độ quá cao có thể dẫn đến các phản ứng phụ không mong muốn.
- Nồng độ xúc tác: Nồng độ xúc tác thích hợp là cần thiết để đảm bảo phản ứng xảy ra hiệu quả.
- Thời gian tiếp xúc: Thời gian ethanol tiếp xúc với chất xúc tác cũng ảnh hưởng đến hiệu suất phản ứng.
Ứng Dụng Của Ethene (C2H4)
Ethene là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp và đời sống:
- Sản xuất Polyethylene (PE): Ethene là monome chính để sản xuất polyethylene, một loại nhựa nhiệt dẻo được sử dụng rộng rãi trong sản xuất bao bì, màng phủ, và nhiều sản phẩm khác.
- Sản xuất Ethylene Oxide: Ethylene oxide là một chất trung gian quan trọng trong sản xuất nhiều hóa chất khác, bao gồm ethylene glycol (chất chống đông) và các chất hoạt động bề mặt.
- Sản xuất Ethylbenzene: Ethylbenzene được sử dụng để sản xuất styrene, một monome quan trọng để sản xuất polystyrene và các loại cao su tổng hợp.
- Ứng dụng trong nông nghiệp: Ethene được sử dụng để thúc đẩy quá trình chín của trái cây và rau quả.
So Sánh với Các Phản Ứng Liên Quan
Để hiểu rõ hơn về phản ứng chuyển đổi C2h6o Ra C2h4, chúng ta có thể so sánh nó với các phản ứng liên quan:
- Phản ứng cộng nước của ethene: Ngược lại với phản ứng loại nước, ethene có thể cộng hợp với nước để tạo thành ethanol. Phản ứng này cũng cần xúc tác axit.
- Phản ứng oxy hóa ethanol: Ethanol có thể bị oxy hóa để tạo thành acetaldehyde hoặc acetic acid, tùy thuộc vào điều kiện phản ứng và chất oxy hóa sử dụng.
Kết Luận
Phản ứng chuyển đổi ethanol thành ethene là một quá trình quan trọng trong hóa học hữu cơ và công nghiệp hóa dầu. Việc hiểu rõ các phương pháp thực hiện, cơ chế phản ứng, và các yếu tố ảnh hưởng đến hiệu suất phản ứng là rất quan trọng để tối ưu hóa quá trình sản xuất ethene và ứng dụng nó trong nhiều lĩnh vực khác nhau.
Công thức cấu tạo của ethanol (C2H6O) và ethene (C2H4), thể hiện sự khác biệt về liên kết giữa các nguyên tử carbon.