Methyl benzoate (MB) là một hợp chất hữu cơ nhỏ, kỵ nước, được phân lập từ dương xỉ nước ngọt Salvinia molesta. Nhờ mùi hương dễ chịu, nó được sử dụng làm chất tăng cường hương vị và mùi thơm. Thêm vào đó, nó được sử dụng để thu hút ong lan để thụ phấn trong trang trại và đã được thử nghiệm về tiềm năng phát triển thành thuốc trừ sâu xanh nhắm mục tiêu vào nhiều loại côn trùng. Mặc dù có nhiều ứng dụng, sự an toàn của MB đối với con người vẫn chưa được hiểu rõ. Trong nghiên cứu này, chúng tôi đã kiểm tra độc tính tế bào của MB đối với các tế bào người nuôi cấy, bao gồm tế bào thận, ruột kết và tế bào thần kinh. Hơn nữa, các axit benzoic tự nhiên và tổng hợp khác như ethyl benzoate (EB) và Vinyl Benzoat (VB) đã được so sánh với MB về tính tương đồng và các ứng dụng thương mại và công nghiệp rộng rãi của chúng. Chúng tôi thấy rằng MB và VB có độc tính tổng thể ít nhất và nhiều nhất đối với các tế bào người được thử nghiệm, tương ứng. Ngoài ra, sự biểu hiện của một số gen liên quan đến chu kỳ tế bào, kiểm soát chất lượng protein và dẫn truyền thần kinh như các gen cyclin D1, HSP70 và ACHE đã được biểu hiện khác nhau khi có mặt các hóa chất này, đáng chú ý nhất là trong điều trị VB. Nghiên cứu của chúng tôi đã cung cấp các giá trị LC50 của các axit benzoic này cho tế bào người in vitro và gợi ý độc tính nhẹ của chúng nên được xem xét trong các ứng dụng công nghiệp và nông nghiệp để nằm trong giới hạn an toàn.
Từ khóa: Khoa học nông nghiệp, Thuốc trừ sâu, Sức khỏe môi trường, Độc chất học, Methyl benzoate, Độc tính tế bào, Biểu hiện gen.
Khoa học nông nghiệp; Thuốc trừ sâu; Sức khỏe môi trường; Độc chất học; Methyl benzoate; Độc tính tế bào; Biểu hiện gen.
1. Giới thiệu
Nông nghiệp bền vững phù hợp với nông nghiệp hiện đại và nhằm mục đích thúc đẩy các phương pháp và phương thức canh tác có lợi nhuận, thân thiện với môi trường và tốt cho cộng đồng. Dân số ngày càng tăng đòi hỏi sự gia tăng số lượng sản phẩm nông nghiệp, bằng cách mở rộng diện tích canh tác hoặc thâm canh nông nghiệp (Pretty and Bharucha, 2014). Phương án sau lý tưởng hơn vì việc mở rộng diện tích canh tác chỉ có thể đạt được bằng cái giá phải trả là môi trường và đất đai có thể sinh sống được. Để tăng sản lượng nông nghiệp trên một đơn vị diện tích, việc sử dụng thuốc trừ sâu bao gồm thuốc diệt cỏ và thuốc trừ sâu là không thể tránh khỏi và đã được chấp nhận rộng rãi như một tập quán nông nghiệp điển hình (https://www.epa.gov/sites/production/files/2017-01/documents/pesticides-industry-sales-usage-2016_0.pdf). Hơn 95% thuốc trừ sâu tiếp cận các sinh vật khác ngoài côn trùng và thảo mộc mục tiêu vì chúng thường được phun hoặc rải trên diện tích canh tác (Feng and Zhang, 2017). Do đó, trừ khi thuốc trừ sâu được theo dõi cẩn thận về độ an toàn và tác động lâu dài đến sức khỏe con người và môi trường, chúng có thể gây ra những tác hại không thể khắc phục và những hậu quả tai hại cho chúng. Trên thực tế, một số thuốc trừ sâu tổng hợp đã được báo cáo là gây hại và gây rủi ro cho sức khỏe con người và môi trường trong quá khứ (Aktar et al., 2009). Điều đáng chú ý là nhiều loài sâu bệnh đã kháng thuốc trừ sâu đang được sử dụng hiện nay, đòi hỏi phải phát triển các loại thuốc trừ sâu mới (Georghiou and Mellon, 1983). Tùy thuộc vào nguồn gốc của chúng, thuốc trừ sâu được phân loại là tự nhiên, có nguồn gốc tự nhiên hoặc tổng hợp. Thuốc trừ sâu tổng hợp được công nhận là nguy hiểm hơn thuốc trừ sâu tự nhiên hoặc có nguồn gốc tự nhiên. Tuy nhiên, thuốc trừ sâu tự nhiên có thể gây ung thư và gây hại như thuốc trừ sâu tổng hợp.
Methyl benzoate [MB; C8H8O2; trọng lượng phân tử (MW), 136,15 g/mol] là một este dễ bay hơi tồn tại tự nhiên như một chất chuyển hóa trong thực vật (Dudareva et al., 2000). Nó được phân lập từ dương xỉ nước ngọt Salvinia molesta lần đầu tiên cách đây khoảng 10 năm (Choudhary et al., 2008). Nó cũng là hợp chất thơm phong phú nhất trong hoa mõm chó được ong thụ phấn (Dudareva et al., 2000). S-Adenosyl-l-methionine: benzoic acid carboxyl methyltransferase (BAMT) chịu trách nhiệm tổng hợp sinh học MB trong hoa mõm chó (Dudareva et al., 2000). BAMT xúc tác quá trình chuyển nhóm methyl của S-adenosyl-l-methionine sang nhóm carboxyl của axit benzoic để tạo ra MB (Kolosova et al., 2001). Ngoài ra, MB được phát ra từ cây lúa bị côn trùng gây hại (Zhao et al., 2010). Vì mùi trái cây của nó, nó được sử dụng trong ngành sản xuất nước hoa và làm thuốc trừ sâu để thu hút ong ăn quả (Breed et al., 2004). Các nghiên cứu gần đây đã chứng minh tác dụng độc hại của MB đối với các loài sâu bệnh khác nhau bao gồm D. suzukii, H. halys và Bemisia tabaci (Feng et al., 2018; Feng and Zhang, 2017; Mostafiz et al., 2018). Các este benzyl tự nhiên khác, chẳng hạn như ethyl benzoate (EB) và benzoate tổng hợp, chẳng hạn như vinyl benzoat (VB), đã được chứng minh là có tác dụng diệt côn trùng đối với một số loài sâu bệnh (Feng et al., 2018). Trong nghiên cứu này, với việc MB và EB có tiềm năng lớn để phát triển thành thuốc trừ sâu xanh ít tác động đến môi trường (Feng et al., 2018), chúng tôi đã kiểm tra độc tính tế bào của chúng trong các tế bào người nuôi cấy, bao gồm tế bào thận phôi người (HEK293), ruột kết (CACO2) và tế bào thần kinh (SH-SY5Y) in vitro. Ngoài ra, ảnh hưởng của các hóa chất này đối với sự tăng sinh tế bào đã được theo dõi bằng mức độ biểu hiện gen và phản ứng căng thẳng tế bào đã được kiểm tra bằng biểu hiện HSP70. Trong nghiên cứu của chúng tôi, chúng tôi đề xuất cung cấp dữ liệu có giá trị để giúp thiết lập giới hạn an toàn của MB, EB và VB cho các ứng dụng của con người và sử dụng trong thuốc trừ sâu trong tương lai.
2. Vật liệu và phương pháp
2.1. Kiểm tra độc tính tế bào
Tế bào thận phôi người 293 (HEK293) và CACO2 được mua từ ATCC. Các tế bào được nuôi cấy trong DMEM (Corning, USA) được bổ sung 10% FBS (Gibco, USA) và 1% penicillin/streptomycin (Gibco, USA). Tế bào SH-SY5Y được tặng bởi phòng thí nghiệm của Tiến sĩ Dong-Hyung Cho tại Khoa Khoa học Đời sống tại Đại học Quốc gia Kyungpook và được nuôi trong DMEM với glucose cao (Gibco, USA). Các tế bào được phát triển đến độ hợp lưu 80–90% trong đĩa 10 cm trước khi phân chia thành đĩa 96 giếng. Khoảng 4 × 104 tế bào được gieo trong mỗi giếng và MB, EB hoặc VB được áp dụng theo nồng độ mục tiêu. MB, EB và VB được hòa tan trong 100% acetone và dung dịch được thêm vào môi trường tế bào là 2% (v/v, 3 μl dung dịch MB đến 150 μl môi trường nuôi cấy tế bào). Đối với các thí nghiệm với Tween 20, 1% Tween 20, 80% acetone và 19% H2O được sử dụng làm dung môi để hòa tan MB. Dung dịch MB bao gồm Tween 20 được thêm vào môi trường tế bào là 2% như mô tả ở trên. Sau 48 giờ ủ bệnh, 10% (v/v) muối tetrazolium hòa tan trong nước (WST, DoGen Inc., Hàn Quốc) đã được thêm vào mỗi giếng, theo hướng dẫn của nhà sản xuất. Sự phát triển màu cam cho phản ứng enzyme-substrate đã được theo dõi, sử dụng quang phổ kế ở 450 nm (Tecan Sunrise, Thụy Sĩ).
Đối với thí nghiệm tinh thể violet, các tế bào được chia thành 96 giếng và MB được áp dụng cho mỗi giếng như mô tả ở trên và sau đó tế bào HEK293 được phát triển trong 1–2 ngày và tế bào CACO2 trong 4–5 ngày. Phương pháp nhuộm tinh thể violet được công bố bởi M. Feoktistova et al., (2016) đã được sử dụng mà không có sửa đổi. Tấm kết quả đã được chụp ảnh. Ngoài ra, các tế bào nhuộm màu đã được hòa tan trong methanol và cường độ màu đã được đo ở 595 nm (Tecan Sunrise, Thụy Sĩ).
2.2. Real-time PCR
Tế bào HEK293 và SH-SY5Y được phát triển đến độ hợp lưu 60–70% trong đĩa 6 giếng và môi trường đã được trao đổi với những tế bào bao gồm các hóa chất, MB, EB hoặc VB ở nồng độ nhất định. Sau 48 giờ ủ bệnh, các tế bào được rửa bằng PBS lạnh một lần và cạo. Các tế bào được rửa lại bằng PBS lạnh hai lần trước khi chiết xuất các phân tử RNA tổng số bằng bộ Qiagen RNeasy. cDNA được xây dựng từ 600 ng RNA thu thập được bằng Hệ thống phiên mã ngược (Promega, Nhật Bản). cDNA đã được phân tích thông qua PCR định lượng thời gian thực bằng cách sử dụng SYBR Green Realtime PCR Master Mix (Toyobo, Nhật Bản) theo hướng dẫn của nhà sản xuất (Hệ thống PCR thời gian thực CFX96 Touch, Bio-Rad). Các mồi được sử dụng cho các thí nghiệm được tóm tắt trong Bảng 2.
Bảng 2.
Các mồi được sử dụng cho PCR thời gian thực.
| Gen đích | Trình tự mồi |
|---|---|
| Cyclin B1 | Forward: 5′-AAT GAA ATT CAG GTT GTT GCA GGA G-3′ |
| Reverse: 5′-CAT GGC AGT GAC ACC AAC CAG-3′ | |
| Cyclin D1 | Forward: 5′-ATG TTC GTG GCC TCT AAG ATG A-3′ |
| Reverse: 5′-CAG GTT CCA CTT GAG CTT GTT C-3′ | |
| HSP70 | Forward: 5′-ATG TCG GTG GTG GGC ATA GA-3′ |
| Reverse: 5′-CAC AGC GAC GTA GCA GCT CT-3′ | |
| ACTIN | Forward: 5′-GCC GAC AGG ATG CAG AAG GAG ATC A-3′ |
| Reverse: 5′-AAG CAT TTG CGG TGG ACG ATG GA-3′ | |
| ACHE | Forward: 5′-GAG AGG ATC TTT GCT CAG CGA C-3′ |
| Reverse: 5′-GAG AAA GCG ATT CCA GAA GGC-3′ |
2.3. Western blot
Tế bào HEK293 được phát triển trong đĩa 6 giếng cho Western blot và điện di gel polyacrylamide SDS (SDS-PAGE) được rửa bằng PBS lạnh hai lần và cạo trong bộ đệm RIPA (Cell Signaling, Cat. 9806, USA). Nồng độ protein trong mỗi mẫu được đo thông qua xét nghiệm Bradford bằng cách sử dụng Bio-Rad Protein Assay Dye Reagent Concentrate (Bio-Rad #5000006) và quang phổ kế ở 595 nm (Tecan Sunrise™ Absorbance Microplate Reader, Thụy Sĩ). Từ nồng độ protein đo được, tổng cộng 15 μg protein trên mỗi mẫu đã được nạp trên gel SDS-PA 7%, thấm lên màng nitrocellulous và thăm dò HSP70 và α-Tubulin bằng kháng thể tương ứng (HSP70, Santa Cruz sc-32239; α-Tubulin, Santa Cruz sc-8035) trong xét nghiệm Western blot.
2.4. Phân tích thống kê
Phân tích phương sai một chiều ANOVA, tiếp theo là kiểm tra HSD Tukey hậu nghiệm, đã được sử dụng để xác định sự khác biệt về độc tính và tỷ lệ đẩy lùi (P Abbott, 1987). Hồi quy Log-probit đã được sử dụng để xác định nồng độ trung bình gây chết người (LC50) dựa trên tỷ lệ tử vong đã điều chỉnh từ các nồng độ MB khác nhau (SAS cho Window release 6, SAS Institute). Tỷ lệ đẩy lùi người lớn được tính bằng công thức PR (%) = [(C-T)/(C + T)] × 100 (Liu et al., 2013). Tất cả các phân tích được thực hiện trong SAS phiên bản 9.4. Tất cả các biểu đồ được vẽ bằng SigmaPlot 12.5 (Systat Software, Inc., San Jose, CA, USA).
3. Kết quả
3.1. Độc tính tế bào của MB đối với tế bào thận người in vitro
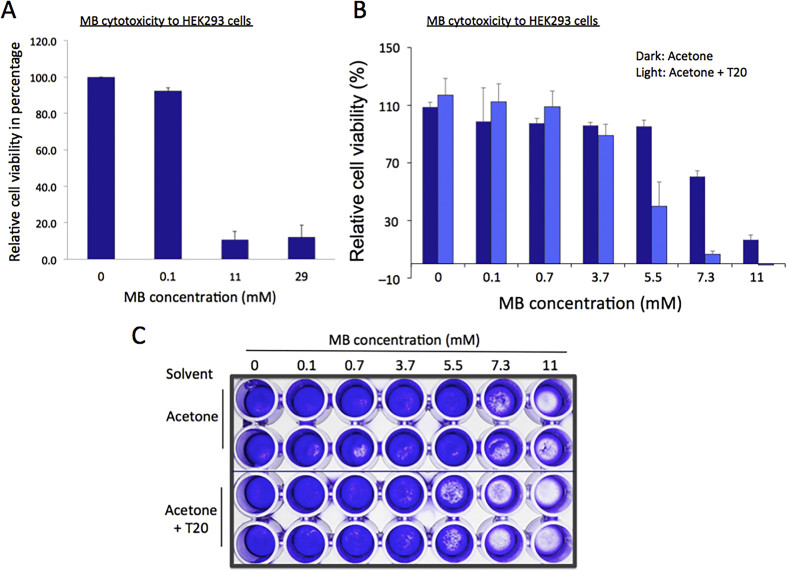
Khi sự an toàn của các sản phẩm nông nghiệp và thực phẩm trở thành một mối quan tâm và vấn đề lớn trong xã hội hiện đại, việc xác nhận tác động của thuốc trừ sâu đối với sinh lý con người và thiết lập các giới hạn an toàn sử dụng của chúng là rất quan trọng (Fan and Jackson, 1989; Kim et al., 2017). Do đó, chúng tôi đã kiểm tra MB về tác động của nó đối với sự tăng trưởng và tăng sinh của các tế bào sau: tế bào thận người nuôi cấy (HEK293) và tế bào ruột kết (CACO2) từ ATCC. Ban đầu, MB ở nồng độ 0, 0,1, 11 và 29 mM (0%, 0,001%, 0,15% và 0,4%) đã được áp dụng cho khoảng 4 × 104 tế bào HEK293 và các tế bào đã được ủ trong 24 giờ trước khi thêm thuốc thử tetrazolium hòa tan trong nước (WST-1). WST-1 là một chất nền của dehydrogenases ty thể và được chuyển đổi thành một loại thuốc nhuộm màu gọi là formazan trong các tế bào khả thi. Vì cường độ của thuốc nhuộm tỷ lệ thuận với lượng enzyme, xét nghiệm tăng sinh tế bào bằng thuốc thử WST-1 được sử dụng rộng rãi để đo khả năng tồn tại của tế bào (Ngamwongsatit et al., 2008). Kết quả cho thấy các tế bào ít khả thi hơn ở >11 mM MB nhưng phát triển tốt ở 0,1 mM MB khi so sánh với đối chứng (Hình 1A).
Do đó, chúng tôi nhằm mục đích xác định giới hạn trên của nồng độ MB trong khoảng từ 0,1 đến 11 mM (0,001% và 0,15%) trong đó sự phát triển của tế bào HEK293 ít bị ảnh hưởng hơn. Bảy nồng độ MB, 0, 0,1, 0,7, 3,7, 5,5, 7,0, 11 mM (0%, 0,001%, 0,01%, 0,05%, 0,075%, 0,1% và 0,15%), đã được áp dụng cho tế bào HEK293 và thí nghiệm WST-1 đã được thực hiện. Kết quả cho thấy nồng độ MB Hình 1B). Những quan sát này phù hợp với những quan sát từ xét nghiệm nhuộm tế bào tinh thể violet được hiển thị trong Hình 1C. Cần lưu ý rằng MB, ở nồng độ cao hơn 5,5 mM (0,075%), đã hình thành các tập hợp màu bạc, chỉ có thể nhìn thấy khi áp dụng cho môi trường. Điều này có thể là do tính kỵ nước của MB khiến nó tạo thành các tập hợp được tạo điều kiện bởi điều kiện nước trong môi trường nuôi cấy tế bào. Do đó, 1% Tween 20 (T20) trong 80% acetone đã được sử dụng để tăng độ hòa tan của MB làm dung môi và hỗn hợp MB đã được áp dụng cho nuôi cấy tế bào ở mức 2% (v/v) (Akbari et al., 2015). Dữ liệu WST-1 tương tự như kết quả không có T20, ngoại trừ 5,5 mM MB. Với việc bổ sung T20, nồng độ MB ≤3,7 mM hầu như không ảnh hưởng đến sự phát triển và tăng sinh tế bào, trong khi nồng độ MB 5,5 mM ức chế chúng đáng kể (Hình 1B). Chúng tôi cho rằng sự gia tăng độ nhạy của nồng độ MB 5,5 mM (0,075%) trong dung môi acetone-T20 là do tác dụng gây độc tế bào hiệp đồng khi có mặt chất tẩy rửa, T20 với MB hoặc độ hòa tan tăng cường của MB. Tuy nhiên, tập hợp màu bạc vẫn được quan sát thấy ở nồng độ MB cao hơn ≥ 5,5 mM mặc dù có thêm T20, cho thấy rằng nguyên nhân trước đây có khả năng là nguyên nhân gây ra sự chết tế bào tăng lên ở 5,5 mM MB. Khi các tế bào được hình dung bằng xét nghiệm tinh thể violet, kết quả cho thấy sự đồng ý với những kết quả được quan sát thấy trong xét nghiệm WST-1, xác nhận rằng nồng độ MB ≤0,05% có thể là giới hạn trên cho khả năng tồn tại của tế bào HEK293 (Hình 1C).
3.2. Độc tính tế bào của MB đối với tế bào ruột kết và tế bào thần kinh người in vitro
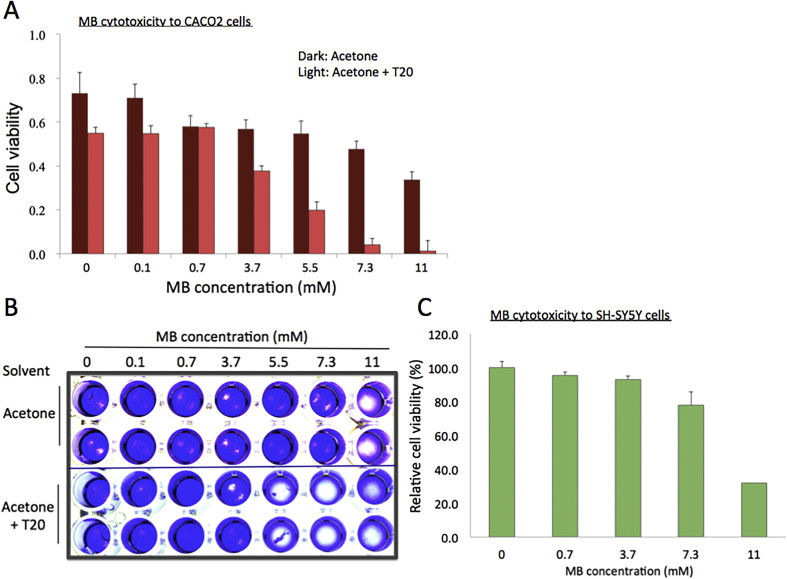
Thuốc trừ sâu dư thừa được ăn vào từ thực phẩm nông nghiệp có thể ở lại trong ruột kết lâu hơn bất kỳ cơ quan nào khác. Do đó, độc tính tế bào MB đối với tế bào biểu mô ruột người, CACO2, đã được khảo nghiệm bằng xét nghiệm nhuộm tế bào WST-1 và tinh thể violet. Mặc dù tế bào HEK293 và CACO2 có tốc độ tăng trưởng khác nhau, nhưng tác dụng của MB đối với hai dòng tế bào này là tương tự nhau trong cả hai xét nghiệm, ngoại trừ việc tế bào CACO2 có vẻ hơi kháng MB hơn. Trong tế bào CACO2, khả năng tồn tại của tế bào giảm 1 và 2A). Ngược lại, độc tính tăng lên đối với tế bào CACO2 đã được quan sát thấy đối với MB hòa tan trong acetone-T20 (Hình 2A). Như được hiển thị trong Hình 2A, nồng độ MB ở 3,7 mM (0,05%) và 7,3 mM (0,1%) dẫn đến giảm khoảng 30% và >90% trong tế bào CACO2 trong xét nghiệm WST-1. Kết quả phù hợp với kết quả từ xét nghiệm tinh thể violet (Hình 2B).
Một hợp chất tương tự như MB, methyl hydroxylbenzoate hoặc methylparaben là một chất chống nấm và đóng vai trò là pheromone cho nhiều loại côn trùng (Nathan and Sears, 1961). Nó cũng đã được sử dụng làm chất bảo quản cho các sản phẩm mỹ phẩm. Ngoài ra, đã có báo cáo rằng methylparaben là một hợp chất hóa học có trong thuốc gây tê cục bộ có thể làm thay đổi chức năng của hệ thần kinh con người (Nathan and Sears, 1961). Do đó, chúng tôi đã kiểm tra xem MB có thể ảnh hưởng đến sinh lý của tế bào thần kinh người, chẳng hạn như sự phát triển và tăng sinh tế bào, bằng cách sử dụng một dòng tế bào ung thư người nuôi cấy, SH-SY5Y. Trong xét nghiệm WST-1, tác dụng độc hại của MB được quan sát thấy đối với tế bào thần kinh tương tự như tế bào thận và ruột kết, trong đó sự giảm đáng chú ý trong sự phát triển được quan sát thấy ở nồng độ MB > 7,3 mM (0,1%, Hình 2C). Chúng tôi đã tính toán các giá trị LC50 của MB cho tế bào HEK293, CACO2 và SH-Y5Y và tóm tắt chúng trong Bảng 1. Những kết quả độc tính tế bào này cho thấy rằng nhìn chung, nồng độ MB > 7,3 mM (0,1%) có vẻ ức chế tế bào người vì nó hạn chế sự phát triển và tăng sinh của chúng.
Bảng 1.
Giá trị LC50 của MB, EB và VB trong dòng tế bào thận, ruột kết và thần kinh của con người.
| Tế bào | Hợp chất | LC50 (%/mM) | 95% CI (dưới-trên) | Độ dốc ± SEM | χ2 (df) |
|---|---|---|---|---|---|
| HEK293 | MB | 0,18/13,2 | 1,81–245,45 | 1,24 (0,11) | 120,06 (4) |
| EB | 0,104/6,9 | n/a | 2,9 (1,5) | 38,6 (2) | |
| VB | 0,08/5,4 | 0,07-0,09 | 2,4 (0,3) | 3,3 (2) | |
| CACO2 | MB | 0,28/20,6 | 0,06-1,94 | 1,07 (0,1) | 15,17 (4) |
| SH-SY5Y | MB | 0,15/11,0 | n/a | 2,0 (1,2) | 44,7 (2) |
| EB | 0,11/7,3 | n/a | 3,2 (2,5) | 90,3 (2) | |
| VB | 0,09/6,1 | n/a | 4,6 (13,4) | 34,6 (2) |
CI, khoảng tin cậy; giá trị LC50 được tính bằng tỷ lệ tử vong phần trăm; n/a, không quan sát thấy khoảng tin cậy và do đó không thực hiện phân tích probit.
3.3. MB có ít độc tính tế bào hơn so với ethyl và vinyl benzoate
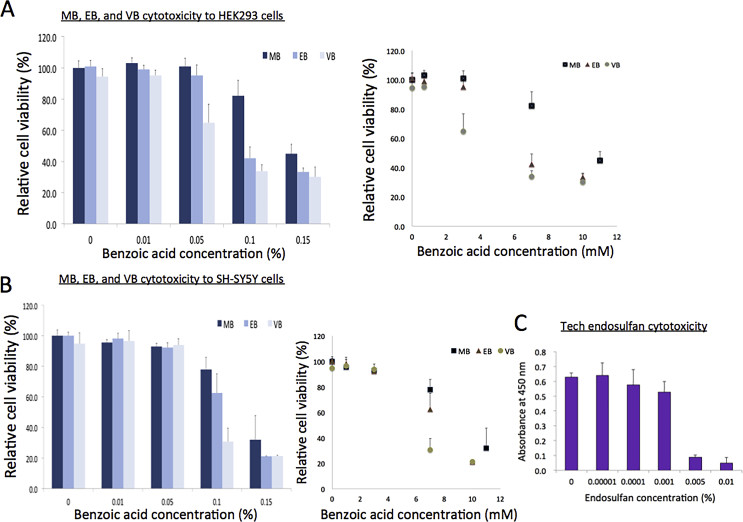
Chúng tôi đã so sánh độc tính tế bào của MB với các benzoat được sử dụng thương mại khác, chẳng hạn như ethyl (EB, C9H10O2; MW, 150,17 g/mol) và vinyl benzoat (VB, C9H8O2, MW, 148,16 g/mol). EB là một hợp chất tự nhiên, như MB, được tìm thấy trong các loại trái cây khác nhau như táo, chuối và anh đào và có thể được hình thành bởi sự ngưng tụ của benzoate và ethanol (https://pubchem.ncbi.nlm.nih.gov/compound/Ethyl-benzoate). Mặt khác, VB là một hợp chất tổng hợp được tổng hợp bằng sự ngưng tụ của nhóm carboxyl của axit benzoate với ethenol (https://pubchem.ncbi.nlm.nih.gov/compound/Vinyl-benzoate). EB thường được sử dụng làm thành phần trong nước hoa và hương vị nhân tạo như được liệt kê trong mã hóa chất thực phẩm và US FDA, trong khi VB được sử dụng làm thuốc thử công nghiệp (Labruere et al., 2010). Xét nghiệm độc tính tế bào, so sánh các hóa chất này trong tế bào HEK293 và SH-SY5Y, cho thấy rằng MB ít độc nhất, tiếp theo là EB, và sau đó VB độc nhất đối với các tế bào được thử nghiệm này (Hình 3A và B, Bảng 1). Giá trị LC50 của VB bằng khoảng một nửa MB, 5,4 mM và 6,1 mM (0,08% và 0,09%) cho HEK293 và SH-SY5Y, tương ứng. Do đó, có thể xem xét độc tính của các benzoat này trong việc đề xuất giới hạn tối đa của liều lượng được chứa trong các sản phẩm thương mại. Độc tính của MB đối với tế bào người in vitro dường như là khiêm tốn. Ví dụ, nó ít độc hơn nhiều so với endosulfan kỹ thuật, một loại thuốc trừ sâu bị cấm ở nhiều quốc gia vì tác dụng nguy hiểm của nó (Hình 3C) (Weber et al., 2010).
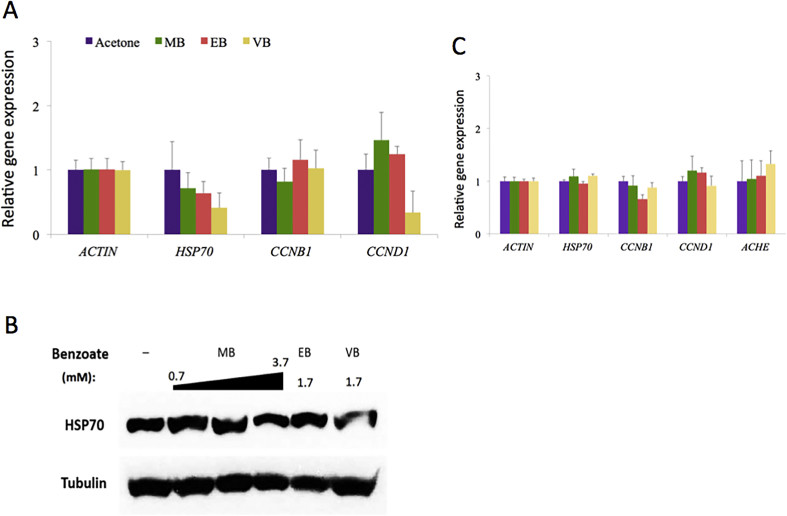
Hơn nữa, chúng tôi đã thúc đẩy đánh giá xem biểu hiện gen của chu kỳ tế bào và các chất điều hòa căng thẳng như cyclin và HSP70 có bị ảnh hưởng bởi MB, EB và VB hay không. Các hóa chất này đã được áp dụng cho tế bào HEK293 hoặc SH-SY5Y ở nồng độ 4,4 mM [0,06% MB, 0,05% (3,7 mM) cho tế bào SH-SY5Y], 1,7 mM (0,025%, EB) và 1,7 mM (0,025%, VB), tương ứng, trong 48 giờ trước khi chiết xuất RNA tổng số từ tế bào. Nồng độ đã được chọn dựa trên giá trị LC50, khoảng một phần ba giá trị, sẽ không gây ra cái chết tế bào nhưng có thể ảnh hưởng đến biểu hiện gen trong các tế bào được thử nghiệm. mRNA của HSP70, CCNB1 (cyclin B1) và CCND1 (cyclin D1) đã được định lượng bằng PCR thời gian thực với ACTIN làm gen tham chiếu. Cyclin B1 là một chất điều hòa điểm kiểm soát cho quá trình chuyển đổi S/G2, trong khi cyclin D1 là cho quá trình tiến triển G1 (Baldin et al., 1993; Hwang et al., 1995). Người ta thấy rằng biểu hiện mRNA cyclin B1 hiếm khi khác biệt trong các tế bào được xử lý bằng MB, EB và VB so với biểu hiện trong các tế bào đối chứng chỉ được xử lý bằng dung môi (acetone) (Hình 4A). Tuy nhiên, chúng tôi đã tìm thấy sự giảm đáng chú ý biểu hiện mRNA cyclin D1 trong tế bào HEK293 được xử lý bằng VB (Hình 4A). Biểu hiện mRNA của HSP70, một gen gây ra căng thẳng (Huang et al., 2001), giảm trong tế bào HEK293 được xử lý bằng MB-, EB- và VB, và các mẫu được xử lý bằng VB cho thấy biểu hiện ít nhất (Hình 4A). Ngoài ra, mức độ protein của HSP70 liên tục giảm trong tế bào HEK293 được xử lý bằng VB (Hình 4B và S1). Ở cùng nồng độ, tế bào SH-SY5Y không hiển thị sự khác biệt đáng chú ý nào trong biểu hiện của các gen này (Hình 4C). Đối với tế bào SH-SY5Y, chúng tôi cũng đo biểu hiện mRNA của AChE, gen acetylcholinesterase (Dvir et al., 2010), vì cấu trúc tương tự của các hóa chất này với methylparaben (Nathan and Sears, 1961) và thực tế là MB đã được báo cáo là có tác dụng đẩy lùi đối với một số loài sâu bệnh như Bemisia tabaci (Gennadius) (Mostafiz et al., 2018). Ở nồng độ nhất định, chỉ có tế bào được xử lý bằng VB cho thấy sự gia tăng nhẹ về mức độ biểu hiện AChE, trong khi hầu như không có thay đổi nào được thấy ở tế bào được xử lý bằng MB- và EB (Hình 4C).
4. Kết luận
Các hóa chất kỵ nước có xu hướng gây hại sau một phạm vi nồng độ nhất định (Bhaganna et al., 2010). Vitamin D là một ví dụ điển hình. Mặc dù nó rất quan trọng và không nên thiếu trong cơ thể con người, nhưng việc tiêu thụ quá nhiều Vitamin D đã được báo cáo là gây ra rủi ro và gây hại cho con người (Marcinowska-Suchowierska et al., 2018). Mặc dù MB được sản xuất tự nhiên bởi thực vật và có vẻ an toàn, nhưng nó là một chất kỵ nước nhỏ đòi hỏi phải kiểm tra cẩn thận về độc tính và nên thiết lập liều lượng an toàn của nó ở người. Chúng tôi đã phát hiện ra rằng MB có thể gây chết người cho tế bào HEK293, CACO2 và SH-SY5Y ở nồng độ cao và đã đưa ra các giá trị LC50 cho các tế bào này. Hai benzoat khác, EB và VB, được tìm thấy độc hơn MB. Tuy nhiên, các hợp chất này có vẻ ít độc hơn so với các thuốc trừ sâu khác như endosulfan kỹ thuật. Hơn nữa, chúng tôi gợi ý rằng các benzoat này khi được áp dụng cho mục đích sử dụng của con người nên ở nồng độ thấp hơn liều lượng an toàn tiêu chuẩn được xác định thông qua các nghiên cứu trên cơ sở tế bào in vitro và trên động vật in vivo trong tương lai.
Phân tích biểu hiện gen đã chỉ ra rằng VB làm giảm biểu hiện mRNA và protein cyclin D1 và HSP70 trong tế bào HEK293. Cyclin D1 là một protein quan trọng cho sự phát triển và tăng sinh tế bào (Baldin et al., 1993). Sự giảm protein này phù hợp với sự phát triển tế bào bị ức chế và độc tính tế bào do VB gây ra. Sự giảm biểu hiện HSP70 có liên quan đến việc kiểm soát chất lượng protein và phản ứng căng thẳng bị tổn hại cũng như lão hóa (Bobkova et al., 2015; Huang et al., 2001). Mặc dù cần có các nghiên cứu sâu hơn để hiểu cơ chế và hậu quả chính xác của việc giảm HSP70, phản ứng căng thẳng kém có thể giải thích độc tính do VB hiển thị đối với con người.
Tuyên bố
Tuyên bố về đóng góp của tác giả
TBC H. Bunch: Lên ý tưởng và thiết kế các thí nghiệm; Phân tích và diễn giải dữ liệu; Đóng góp thuốc thử, vật liệu, công cụ phân tích hoặc dữ liệu; Viết bài báo.
J. Park, H. Choe và M. Mostafiz: Thực hiện các thí nghiệm; Phân tích và diễn giải dữ liệu.
K. Lee: Phân tích và diễn giải dữ liệu; Đóng góp thuốc thử, vật liệu, công cụ phân tích hoặc dữ liệu.
J. Kim: Đóng góp thuốc thử, vật liệu, công cụ phân tích hoặc dữ liệu.
Tuyên bố tài trợ
H. Bunch được hỗ trợ bởi Quỹ Nghiên cứu Đại học Quốc gia Kyungpook, 2017.
Tuyên bố cạnh tranh lợi ích
Các tác giả tuyên bố không có xung đột lợi ích.
Thông tin bổ sung
Nội dung bổ sung liên quan đến bài viết này có sẵn trong Hình bổ sung 1.
Lời cảm ơn
Chúng tôi đánh giá cao các đồng nghiệp và sinh viên phòng thí nghiệm của chúng tôi tại Trường Khoa học Sinh học Ứng dụng tại Đại học Quốc gia Kyungpook (KNU). Chúng tôi cảm ơn S. Heo tại KNU vì sự hỗ trợ kỹ thuật. H.B. biết ơn G.P. Hugenberger, D.Y. Bunch và John vì sự hỗ trợ và khuyến khích yêu thương của

