Nitrogen (N₂) là một khí trơ ở điều kiện thường, nhưng lại có thể phản ứng với oxygen (O₂) ở nhiệt độ cao hoặc khi có tia lửa điện để tạo thành nitrogen monoxide (NO). Vậy, điều gì khiến cho phản ứng này chỉ xảy ra trong những điều kiện khắc nghiệt như vậy?
Phản ứng giữa nitrogen và oxygen được biểu diễn như sau:
N₂(g) + O₂(g) → 2NO(g)
Để hiểu rõ hơn, chúng ta cần xem xét đến năng lượng liên kết và biến thiên enthalpy của phản ứng.
Năng lượng liên kết và biến thiên Enthalpy
Biến thiên enthalpy (∆H) của một phản ứng cho biết lượng nhiệt được hấp thụ (phản ứng thu nhiệt, ∆H > 0) hoặc giải phóng (phản ứng tỏa nhiệt, ∆H < 0) trong quá trình phản ứng. Để tính ∆H của phản ứng trên dựa vào năng lượng liên kết, ta sử dụng công thức:
∆H = ∑E(liên kết bị phá vỡ) – ∑E(liên kết được hình thành)
Trong phản ứng này:
- Liên kết bị phá vỡ: Một liên kết ba N≡N trong N₂ và một liên kết đôi O=O trong O₂.
- Liên kết được hình thành: Hai liên kết đôi N=O trong 2NO.
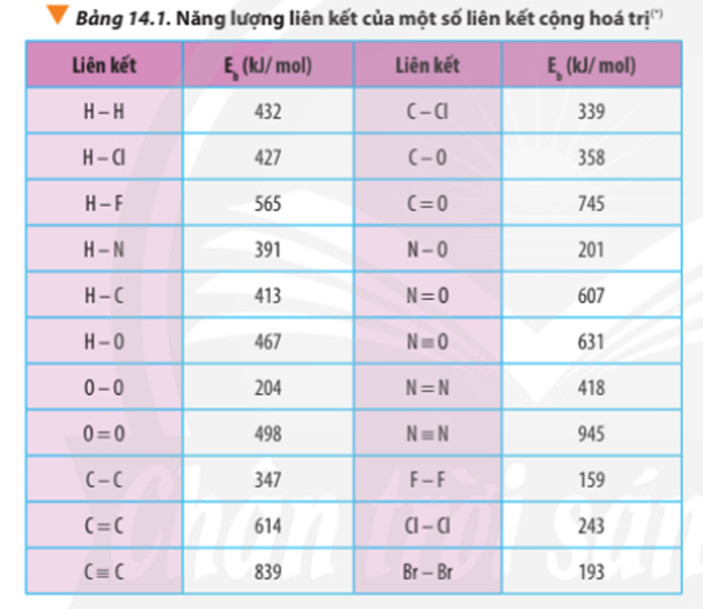 Bảng năng lượng liên kết cho các chất N2, O2 và NO để tính biến thiên enthalpy của phản ứng
Bảng năng lượng liên kết cho các chất N2, O2 và NO để tính biến thiên enthalpy của phản ứng
Giả sử chúng ta có các giá trị năng lượng liên kết như sau (kJ/mol):
- E(N≡N) = 945 kJ/mol
- E(O=O) = 498 kJ/mol
- E(N=O) = 607 kJ/mol
Khi đó, biến thiên enthalpy của phản ứng là:
∆H = [E(N≡N) + E(O=O)] – [2 E(N=O)]
∆H = [945 + 498] – [2 607]
∆H = 1443 – 1214 = 229 kJ/mol
Kết quả này cho thấy phản ứng giữa nitrogen và oxygen là một phản ứng thu nhiệt (∆H > 0). Điều này có nghĩa là cần cung cấp một lượng lớn năng lượng (229 kJ) để phá vỡ các liên kết ban đầu và hình thành các liên kết mới.
Giải thích tại sao cần nhiệt độ cao hoặc tia lửa điện
-
Liên kết ba của Nitrogen: Phân tử nitrogen (N₂) có một liên kết ba rất bền (N≡N). Liên kết này đòi hỏi một lượng lớn năng lượng để phá vỡ. Ở nhiệt độ thường, các phân tử không có đủ động năng để vượt qua rào cản năng lượng này.
-
Phản ứng thu nhiệt: Như đã tính toán ở trên, phản ứng N₂ + O₂ → 2NO là một phản ứng thu nhiệt. Để phản ứng xảy ra, cần cung cấp năng lượng từ bên ngoài để bù đắp cho sự thiếu hụt năng lượng.
-
Nhiệt độ cao: Khi nhiệt độ tăng lên, các phân tử nitrogen và oxygen có động năng lớn hơn. Điều này làm tăng khả năng va chạm giữa các phân tử và cung cấp đủ năng lượng để phá vỡ liên kết ba của nitrogen và liên kết đôi của oxygen.
-
Tia lửa điện: Tia lửa điện cung cấp một nguồn năng lượng cục bộ rất lớn. Năng lượng này có thể kích hoạt phản ứng bằng cách phá vỡ liên kết trong phân tử nitrogen và oxygen, tạo điều kiện cho sự hình thành nitrogen monoxide. Tia lửa điện tạo ra các ion và gốc tự do, các tác nhân trung gian hoạt động hơn, giúp phản ứng xảy ra dễ dàng hơn.
Ứng dụng và tầm quan trọng
Phản ứng giữa nitrogen và oxygen để tạo thành nitrogen monoxide là bước đầu tiên trong quá trình sản xuất phân bón và các hợp chất nitrogen khác. Mặc dù cần điều kiện khắc nghiệt để xảy ra, phản ứng này có vai trò quan trọng trong công nghiệp và nông nghiệp.
Ngoài ra, phản ứng này cũng xảy ra trong tự nhiên, ví dụ như trong các cơn giông bão, nơi tia sét cung cấp năng lượng để nitrogen và oxygen trong không khí phản ứng với nhau. Nitrogen monoxide tạo ra sau đó có thể chuyển hóa thành các dạng nitrogen khác, đóng góp vào chu trình nitrogen trong tự nhiên.
Kết luận
Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện do năng lượng liên kết ba rất bền của nitrogen và tính thu nhiệt của phản ứng. Việc cung cấp năng lượng dưới dạng nhiệt độ cao hoặc tia lửa điện giúp phá vỡ các liên kết cũ và hình thành các liên kết mới, cho phép phản ứng xảy ra.

