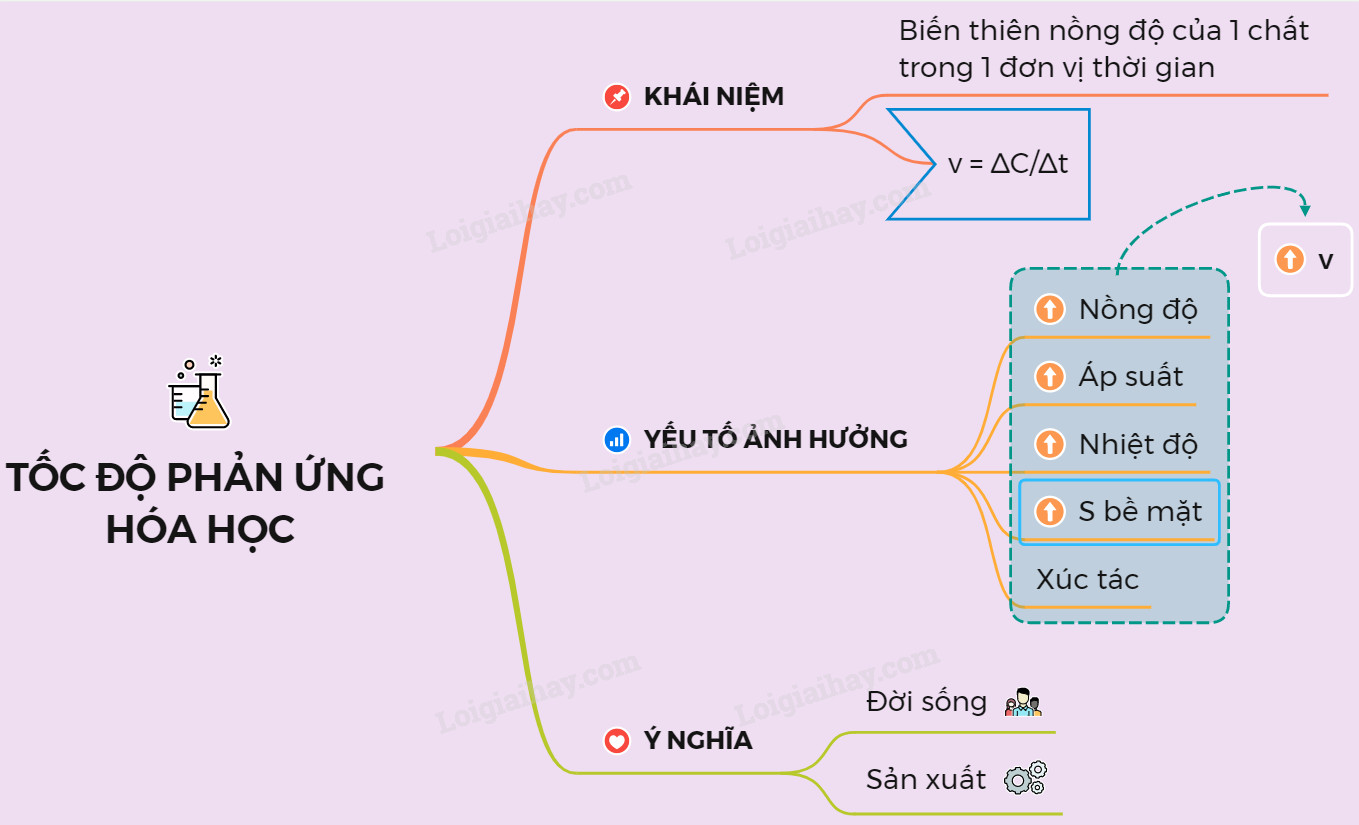
1. Định Nghĩa Tốc Độ Phản Ứng
Tốc độ Phản ứng hóa học là thước đo mức độ thay đổi nồng độ của các chất tham gia hoặc sản phẩm trong một khoảng thời gian nhất định. Nói cách khác, nó cho biết phản ứng diễn ra nhanh hay chậm.
Công thức tính tốc độ phản ứng trung bình (v) được biểu diễn như sau:
v = |ΔC| / Δt (mol/l.s)
Trong đó:
- ΔC là độ biến thiên nồng độ (mol/l)
- Δt là khoảng thời gian (s)
Đối với chất phản ứng, nồng độ giảm dần theo thời gian, nên ΔC = Cđầu – Csau.
Đối với sản phẩm, nồng độ tăng dần theo thời gian, nên ΔC = Csau – Cđầu.
Xét phản ứng tổng quát:
aA + bB → cC + dD
Tốc độ phản ứng có thể được tính dựa trên sự thay đổi nồng độ của bất kỳ chất nào trong phản ứng:
v = (|ΔCA| / aΔt) = (|ΔCB| / bΔt) = (|ΔCC| / cΔt) = (|ΔCD| / dΔt)
2. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng
Nhiều yếu tố có thể tác động đến tốc độ phản ứng hóa học, bao gồm nồng độ, nhiệt độ, áp suất (đối với phản ứng có chất khí), diện tích bề mặt (đối với phản ứng có chất rắn) và chất xúc tác.
a) Nồng Độ
Nồng độ của các chất phản ứng có ảnh hưởng trực tiếp đến tốc độ phản ứng. Khi nồng độ tăng, số lượng phân tử chất phản ứng trong một đơn vị thể tích tăng lên, dẫn đến số lượng va chạm hiệu quả giữa các phân tử tăng lên, làm tăng tốc độ phản ứng.
b) Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng nhất ảnh hưởng đến tốc độ phản ứng. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, dẫn đến:
- Tăng tần số va chạm giữa các phân tử.
- Tăng năng lượng của các va chạm, làm tăng số lượng va chạm hiệu quả (va chạm có đủ năng lượng để phá vỡ liên kết cũ và hình thành liên kết mới).
Do đó, tốc độ phản ứng tăng khi nhiệt độ tăng.
 Phản ứng hóa học diễn ra nhanh hơn ở nhiệt độ cao hơn, do các phân tử có nhiều năng lượng động hơn và va chạm thường xuyên hơn.
Phản ứng hóa học diễn ra nhanh hơn ở nhiệt độ cao hơn, do các phân tử có nhiều năng lượng động hơn và va chạm thường xuyên hơn.
c) Áp Suất
Đối với các phản ứng có chất khí tham gia, áp suất có ảnh hưởng đáng kể đến tốc độ phản ứng. Khi áp suất tăng, nồng độ của các chất khí tăng lên (do thể tích giảm), dẫn đến tăng tần số va chạm giữa các phân tử khí và tăng tốc độ phản ứng.
d) Diện Tích Bề Mặt
Đối với các phản ứng có chất rắn tham gia, diện tích bề mặt tiếp xúc giữa các chất phản ứng đóng vai trò quan trọng. Khi diện tích bề mặt tăng, số lượng phân tử chất rắn tiếp xúc trực tiếp với các chất phản ứng khác tăng lên, làm tăng tốc độ phản ứng. Ví dụ, một viên than lớn sẽ cháy chậm hơn nhiều so với than củi nghiền nhỏ.
e) Chất Xúc Tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác hoạt động bằng cách cung cấp một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
Có hai loại chất xúc tác:
- Chất xúc tác dương: Làm tăng tốc độ phản ứng. Chúng được sử dụng rộng rãi trong công nghiệp, ví dụ như trong quá trình tổng hợp amoniac (NH3), sản xuất axit sulfuric (H2SO4) và axit nitric (HNO3).
- Chất xúc tác âm (chất ức chế): Làm giảm tốc độ phản ứng. Ví dụ, glixerin có thể làm chậm quá trình oxy hóa natri sulfit (Na2SO3) trong dung dịch.
