Tỉ Lệ Mol là một khái niệm quan trọng trong hóa học, đặc biệt khi giải các bài toán liên quan đến phản ứng hóa học. Nó cho biết mối quan hệ định lượng giữa các chất tham gia và sản phẩm trong một phản ứng.
Xét ví dụ, hỗn hợp gồm Natri (Na) và Nhôm (Al) có tỉ lệ mol tương ứng là 1:2 được cho vào nước dư. Sau phản ứng hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Vậy giá trị của m là bao nhiêu?
Để giải quyết bài toán này, chúng ta cần hiểu rõ các phương trình phản ứng xảy ra và sử dụng tỉ lệ mol để tính toán.
Đầu tiên, xác định số mol của H2: nH2 = 8,96 lít / 22,4 lít/mol = 0,4 mol
Gọi số mol của Na là x, thì số mol của Al là 2x (do tỉ lệ mol là 1:2).
Các phản ứng xảy ra như sau:
- Na + H2O → NaOH + 1/2 H2
- 2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
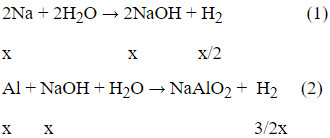 Phản ứng của Natri với nước tạo thành Natri hidroxit và khí hidro.
Phản ứng của Natri với nước tạo thành Natri hidroxit và khí hidro.
Theo phương trình (1) và (2), ta có:
Từ phương trình phản ứng và tỉ lệ mol, ta có thể suy ra mối liên hệ giữa lượng chất phản ứng và sản phẩm tạo thành.
NaOH tạo ra từ phản ứng của Na sẽ phản ứng với Al. Do đó, số mol NaOH bằng số mol Na, tức là x.
Tổng số mol H2 tạo ra từ cả hai phản ứng là 0,4 mol. Ta có phương trình:
0.5x + 3x/2 = 0.4
Giải phương trình, ta được x = 0,2 mol.
Vậy, số mol Al ban đầu là 2x = 0,2 * 2 = 0,4 mol. Số mol Al phản ứng là x = 0,2 mol. Suy ra số mol Al dư là 0,4 – 0,2 = 0,2 mol.
Khối lượng Al dư là m = 0,2 mol * 27 g/mol = 5,4 g.
Ứng dụng của tỉ lệ mol trong các bài toán hóa học:
- Tính toán lượng chất: Xác định lượng chất cần thiết để phản ứng hoàn toàn hoặc lượng sản phẩm tạo thành dựa trên lượng chất đã biết và tỉ lệ mol trong phương trình phản ứng.
- Xác định chất dư: Biết tỉ lệ mol giúp xác định chất nào còn dư sau phản ứng.
- Giải các bài toán hỗn hợp: Khi có nhiều chất tham gia phản ứng, việc xác định tỉ lệ mol giữa chúng giúp giải quyết bài toán dễ dàng hơn.
Ví dụ khác:
Hòa tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước, thu được dung dịch X và 2,688 lít khí H2 (đktc). Dung dịch Y gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4:1. Trung hòa dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là bao nhiêu?
Trong ví dụ này, việc xác định tỉ lệ mol giữa HCl và H2SO4 trong dung dịch Y là yếu tố quan trọng để tính toán lượng muối tạo thành sau phản ứng trung hòa.
Tóm lại, tỉ lệ mol là một công cụ hữu ích trong hóa học, giúp chúng ta hiểu rõ hơn về mối quan hệ định lượng giữa các chất và giải quyết các bài toán phức tạp một cách hiệu quả. Việc nắm vững khái niệm và cách áp dụng tỉ lệ mol là rất quan trọng để thành công trong môn hóa học.