Trong chương trình Hóa học, đặc biệt ở lớp 10, kiến thức về Sơ đồ Cấu Tạo Nguyên Tử đóng vai trò nền tảng. Hiểu rõ cấu trúc nguyên tử, các thành phần và cách chúng tương tác sẽ giúp bạn dễ dàng chinh phục các bài tập và khám phá sâu hơn về thế giới hóa học. Bài viết này sẽ cung cấp một cái nhìn toàn diện và chi tiết về sơ đồ cấu tạo nguyên tử, vượt xa những kiến thức cơ bản, đồng thời tối ưu hóa cho việc tìm kiếm trên Google tại Việt Nam.
1. Nguyên Tử và Các Thành Phần Cơ Bản
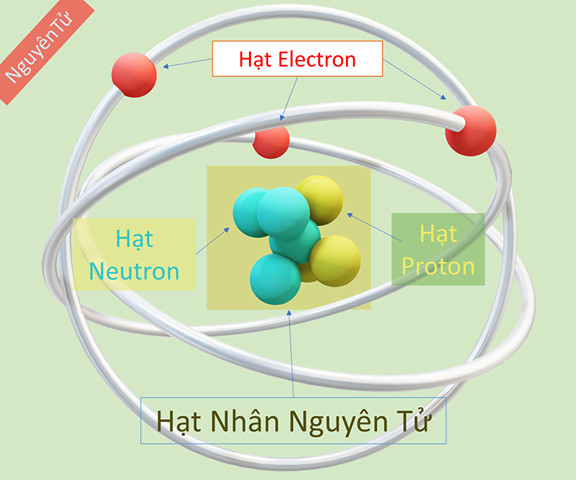
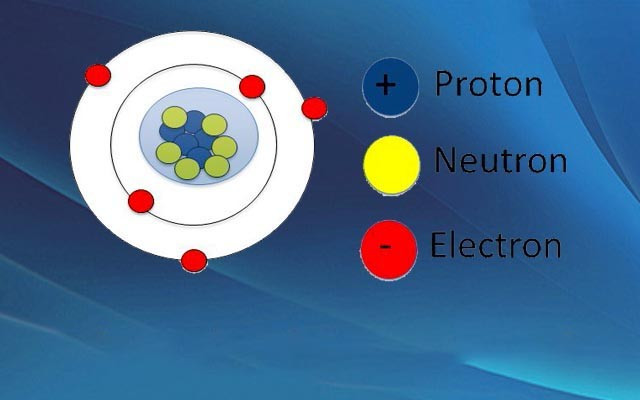
Nguyên tử là đơn vị cấu tạo cơ bản của vật chất, trung hòa về điện. Cấu trúc của nguyên tử bao gồm:
- Hạt nhân: Nằm ở trung tâm, chứa các hạt proton mang điện tích dương và neutron không mang điện.
- Vỏ nguyên tử: Bao gồm các electron mang điện tích âm, chuyển động xung quanh hạt nhân theo các quỹ đạo nhất định.
1.1. Các Hạt Subatomic: Proton, Neutron và Electron
- Proton (p): Mang điện tích dương (+1), nằm trong hạt nhân. Số proton quyết định nguyên tố hóa học.
- Neutron (n): Không mang điện (trung hòa), nằm trong hạt nhân. Số neutron ảnh hưởng đến đồng vị của nguyên tố.
- Electron (e): Mang điện tích âm (-1), chuyển động xung quanh hạt nhân. Số electron quyết định tính chất hóa học của nguyên tố.
Bảng dưới đây tóm tắt các đặc điểm của các hạt cấu tạo nguyên tử:
| Hạt | Điện tích (C) | Khối lượng (kg) | Vị trí |
|---|---|---|---|
| Proton | +1.602 x 10^-19 | 1.6726 x 10^-27 | Hạt nhân |
| Neutron | 0 | 1.6749 x 10^-27 | Hạt nhân |
| Electron | -1.602 x 10^-19 | 9.1094 x 10^-31 | Vỏ nguyên tử |
2. Sơ Đồ Cấu Tạo Nguyên Tử: Lớp và Phân Lớp Electron
Electron không chuyển động hỗn loạn xung quanh hạt nhân mà tuân theo các mức năng lượng nhất định, tạo thành các lớp và phân lớp.
2.1. Lớp Electron (Vỏ Electron)
- Các electron có mức năng lượng gần nhau tạo thành một lớp.
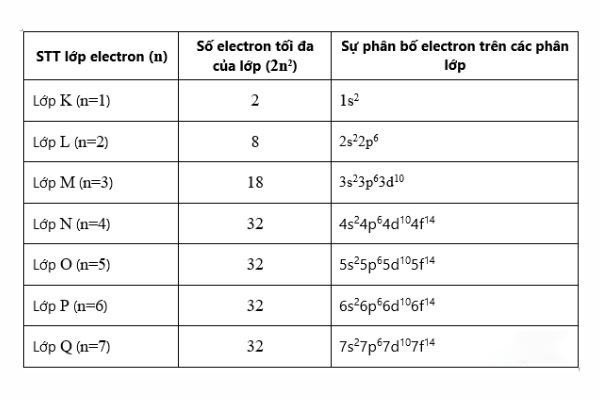
- Có 7 lớp electron, được ký hiệu từ 1 đến 7 hoặc bằng các chữ cái K, L, M, N, O, P, Q (K gần hạt nhân nhất).
- Số electron tối đa trong mỗi lớp tuân theo công thức: 2n², với n là số thứ tự của lớp. Ví dụ: lớp K (n=1) chứa tối đa 2 electron, lớp L (n=2) chứa tối đa 8 electron.
2.2. Phân Lớp Electron
Mỗi lớp electron lại được chia thành các phân lớp, ký hiệu bằng các chữ cái s, p, d, f.
- Phân lớp s: Có hình cầu, chứa tối đa 2 electron.
- Phân lớp p: Có hình số 8 nổi, chứa tối đa 6 electron.
- Phân lớp d: Có hình dạng phức tạp hơn, chứa tối đa 10 electron.
- Phân lớp f: Có hình dạng rất phức tạp, chứa tối đa 14 electron.
Ví dụ: Lớp K chỉ có phân lớp s (1s), lớp L có phân lớp s và p (2s, 2p), lớp M có phân lớp s, p và d (3s, 3p, 3d),…
3. Cấu Hình Electron: Cách Xác Định và Viết
Cấu hình electron biểu diễn sự phân bố electron vào các lớp và phân lớp. Để viết cấu hình electron, cần tuân theo các nguyên tắc sau:
- Nguyên tắc Aufbau: Electron chiếm các orbital có mức năng lượng thấp trước.
- Nguyên tắc Pauli: Mỗi orbital chỉ chứa tối đa 2 electron với spin ngược nhau.
- Quy tắc Hund: Trong cùng một phân lớp, electron sẽ phân bố sao cho số electron độc thân (spin song song) là tối đa.
Thứ tự mức năng lượng của các orbital: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s…
Ví dụ:
- Natri (Na, Z=11): 1s² 2s² 2p⁶ 3s¹
- Oxy (O, Z=8): 1s² 2s² 2p⁴
4. Ý Nghĩa Của Sơ Đồ Cấu Tạo Nguyên Tử
Hiểu rõ sơ đồ cấu tạo nguyên tử có nhiều ứng dụng quan trọng:
- Giải thích tính chất hóa học: Cấu hình electron quyết định khả năng tham gia phản ứng hóa học của nguyên tử.
- Dự đoán liên kết hóa học: Dựa vào số electron lớp ngoài cùng, có thể dự đoán khả năng tạo liên kết ion, cộng hóa trị.
- Hiểu về bảng tuần hoàn: Vị trí của nguyên tố trong bảng tuần hoàn liên quan trực tiếp đến cấu hình electron của nó.
5. Bài Tập Về Sơ Đồ Cấu Tạo Nguyên Tử (Có Đáp Án)
Dưới đây là một số dạng bài tập thường gặp về sơ đồ cấu tạo nguyên tử, kèm theo lời giải chi tiết:
Bài 1: Một nguyên tử X có tổng số hạt là 36, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định số proton, neutron và electron trong nguyên tử X.
Lời giải:
- Gọi số proton là P, số neutron là N, số electron là E.
- Theo đề bài: P + N + E = 36 và P + E – N = 12
- Vì số proton bằng số electron (P = E), ta có: 2P + N = 36 và 2P – N = 12
- Giải hệ phương trình, ta được: P = 12, N = 12, E = 12
- Vậy, nguyên tử X có 12 proton, 12 neutron và 12 electron.
Bài 2: Viết cấu hình electron của nguyên tố Kali (K, Z=19).
Lời giải:
- Kali có 19 electron.
- Cấu hình electron của Kali: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
Bài 3: Nguyên tố X có cấu hình electron lớp ngoài cùng là ns² np⁴. Xác định vị trí của X trong bảng tuần hoàn và cho biết X là kim loại, phi kim hay khí hiếm.
Lời giải:
- Cấu hình electron lớp ngoài cùng là ns² np⁴ cho thấy X có 6 electron lớp ngoài cùng.
- X thuộc nhóm VIA (hoặc nhóm 16) trong bảng tuần hoàn.
- Vì có 6 electron lớp ngoài cùng, X là phi kim.
6. Kết Luận
Sơ đồ cấu tạo nguyên tử là một khái niệm quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của vật chất. Bằng cách nắm vững các kiến thức về thành phần nguyên tử, lớp và phân lớp electron, cấu hình electron, bạn sẽ có nền tảng vững chắc để chinh phục các kiến thức hóa học nâng cao. Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn toàn diện và hữu ích về sơ đồ cấu tạo nguyên tử.