Phản ứng hóa học là quá trình biến đổi chất này thành chất khác. Trong quá trình này, năng lượng có thể được giải phóng hoặc hấp thụ. Bài viết này sẽ tập trung vào một loại phản ứng quan trọng: phản ứng tỏa nhiệt.
Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng ra môi trường dưới dạng nhiệt, ánh sáng hoặc âm thanh. Đặc điểm chính của phản ứng này là nhiệt độ của hệ phản ứng tăng lên, do năng lượng được giải phóng. Về mặt nhiệt động lực học, phản ứng tỏa nhiệt có entanpi (ΔH) âm (ΔH < 0), cho thấy hệ thống mất năng lượng vào môi trường xung quanh.
Ví Dụ Về Phản Ứng Tỏa Nhiệt
Có rất nhiều ví dụ về phản ứng tỏa nhiệt trong cuộc sống hàng ngày và trong công nghiệp:
-
Đốt cháy: Đốt cháy nhiên liệu như gỗ, than, khí đốt tự nhiên đều là các phản ứng tỏa nhiệt mạnh mẽ.
{width=700 height=429}Phản ứng đốt cháy than đá tỏa nhiệt và ánh sáng, thể hiện quá trình tỏa nhiệt diễn ra mạnh mẽ.
-
Phản ứng giữa axit và bazơ: Khi axit và bazơ trung hòa nhau, nhiệt được giải phóng.
-
Sự hình thành băng từ nước: Quá trình đóng băng nước cũng là một phản ứng tỏa nhiệt.
-
Phản ứng nhiệt nhôm: Phản ứng giữa nhôm và oxit kim loại (ví dụ Fe2O3) tỏa nhiệt lớn, được ứng dụng trong hàn đường ray.
Phân Biệt Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Để hiểu rõ hơn về phản ứng tỏa nhiệt, chúng ta cần so sánh nó với phản ứng thu nhiệt. Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng từ môi trường xung quanh để xảy ra.
| Đặc Điểm | Phản Ứng Tỏa Nhiệt | Phản Ứng Thu Nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng ra môi trường | Hấp thụ năng lượng từ môi trường |
| Enthalpy (ΔH) | Âm (ΔH < 0) | Dương (ΔH > 0) |
| Nhiệt độ | Nhiệt độ hệ phản ứng tăng | Nhiệt độ hệ phản ứng giảm |
| Tính tự phát | Có thể xảy ra tự phát | Không thể xảy ra tự phát, cần cung cấp năng lượng |
| Ví dụ | Đốt cháy, phản ứng axit-bazơ, sự hình thành băng | Quang hợp, điện phân nước, hòa tan muối amoni clorua |
Ý Nghĩa của Dấu và Giá Trị ΔH trong Phản Ứng Tỏa Nhiệt
Giá trị ΔH (entanpi) cho biết lượng nhiệt được giải phóng hoặc hấp thụ trong một phản ứng. Dấu âm (-) của ΔH trong phản ứng tỏa nhiệt biểu thị rằng năng lượng đã được giải phóng ra môi trường. Giá trị tuyệt đối của ΔH cho biết lượng nhiệt được giải phóng. Ví dụ, nếu ΔH = -200 kJ, điều này có nghĩa là phản ứng giải phóng 200 kJ nhiệt.
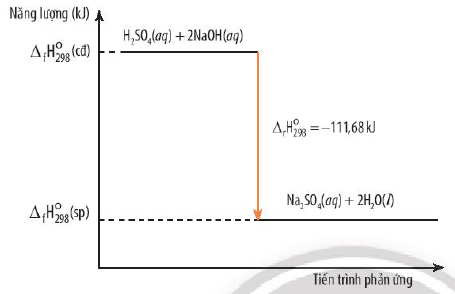{width=455 height=294}Sơ đồ entanpi minh họa phản ứng tỏa nhiệt, thể hiện sự giảm năng lượng từ chất phản ứng sang sản phẩm.
Ứng Dụng Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt có rất nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất năng lượng: Các nhà máy điện đốt cháy than, dầu, khí đốt để tạo ra nhiệt, từ đó sản xuất điện.
- Sưởi ấm: Đốt củi, than để sưởi ấm nhà cửa trong mùa đông.
- Hàn kim loại: Phản ứng nhiệt nhôm được sử dụng để hàn đường ray và các kết cấu kim loại lớn.
- Sản xuất hóa chất: Nhiều phản ứng hóa học tỏa nhiệt được sử dụng trong sản xuất các hóa chất quan trọng.
Kết Luận
Phản ứng tỏa nhiệt là một loại phản ứng hóa học quan trọng, đóng vai trò then chốt trong nhiều quá trình tự nhiên và công nghiệp. Hiểu rõ về phản ứng tỏa nhiệt, các đặc điểm và ứng dụng của nó giúp chúng ta ứng dụng nó một cách hiệu quả vào thực tiễn. Việc nắm vững kiến thức về phản ứng tỏa nhiệt là nền tảng quan trọng trong học tập và nghiên cứu hóa học.

