Phản ứng hóa học là quá trình biến đổi chất, đi kèm với sự thay đổi năng lượng. Trong đó, Phản ứng Tỏa Nhiệt đóng vai trò quan trọng, giải phóng năng lượng ra môi trường xung quanh. Bài viết này sẽ đi sâu vào khái niệm phản ứng tỏa nhiệt, so sánh với phản ứng thu nhiệt, đồng thời làm rõ ý nghĩa và ứng dụng của chúng trong thực tế.
Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc âm thanh. Đặc điểm nổi bật của phản ứng tỏa nhiệt là sự giảm enthalpy (ΔH < 0), nghĩa là năng lượng của sản phẩm thấp hơn năng lượng của chất phản ứng. Do đó, nhiệt được giải phóng ra môi trường, làm tăng nhiệt độ xung quanh.
Một phản ứng tỏa nhiệt có thể xảy ra tự phát và thường dẫn đến sự gia tăng entropy (S > 0) của hệ thống.
Ví Dụ Về Phản Ứng Tỏa Nhiệt
Có rất nhiều phản ứng tỏa nhiệt diễn ra xung quanh chúng ta, trong cả tự nhiên và đời sống hàng ngày. Dưới đây là một số ví dụ điển hình:
-
Đốt cháy nhiên liệu: Quá trình đốt cháy các nhiên liệu như gỗ, than đá, xăng, dầu… đều là phản ứng tỏa nhiệt mạnh mẽ, giải phóng nhiệt và ánh sáng.
C + O2 → CO2
Phản ứng đốt cháy than tỏa nhiệt, cung cấp năng lượng cho việc nấu nướng và sưởi ấm.
-
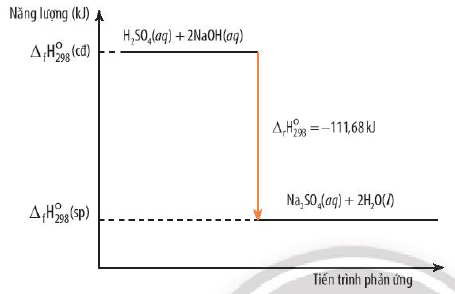
Phản ứng trung hòa: Phản ứng giữa axit và bazơ luôn là phản ứng tỏa nhiệt.
H2SO4 (aq) + 2NaOH (aq) → Na2SO4 (aq) + 2 H2O (l)
ΔH298o = -111.68 kJ
-
Phản ứng nhiệt nhôm: Phản ứng giữa nhôm và oxit kim loại (ví dụ Fe2O3) tỏa ra lượng nhiệt lớn, đủ để làm nóng chảy kim loại tạo thành.
2Al + Fe2O3 → Al2O3 + 2Fe
Phản ứng nhiệt nhôm tỏa nhiệt lượng lớn, được ứng dụng trong hàn đường ray.
-
Sự hình thành băng từ nước: Quá trình này giải phóng nhiệt ra môi trường.
Phân Biệt Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Để hiểu rõ hơn về phản ứng tỏa nhiệt, cần so sánh với phản ứng thu nhiệt.
| Đặc điểm | Phản ứng tỏa nhiệt | Phản ứng thu nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng ra môi trường | Hấp thụ năng lượng từ môi trường |
| Enthalpy (ΔH) | Âm (< 0) | Dương (> 0) |
| Nhiệt độ | Tăng nhiệt độ môi trường | Giảm nhiệt độ môi trường |
| Khả năng tự xảy ra | Có thể tự xảy ra | Cần cung cấp năng lượng để xảy ra |
| Ví dụ | Đốt cháy nhiên liệu, phản ứng trung hòa, nhiệt nhôm | Phân hủy CaCO3, hòa tan NH4Cl, quang hợp |
Biến Thiên Enthalpy Chuẩn của Phản Ứng Tỏa Nhiệt
Biến thiên enthalpy chuẩn (ΔrH298o) là lượng nhiệt tỏa ra hoặc thu vào của phản ứng ở điều kiện chuẩn (25°C và 1 bar). Đối với phản ứng tỏa nhiệt, ΔrH298o có giá trị âm, thể hiện năng lượng giải phóng ra môi trường.
Ý Nghĩa của Dấu và Giá Trị ΔrH298o
- Dấu âm (-) của ΔrH298o cho biết phản ứng là tỏa nhiệt.
- Giá trị tuyệt đối của ΔrH298o thể hiện lượng nhiệt được giải phóng khi phản ứng xảy ra với số mol chất phản ứng đúng như hệ số trong phương trình hóa học.
 Sơ đồ biểu diễn Enthalpy của phản ứng toả nhiệt và thu nhiệt
Sơ đồ biểu diễn Enthalpy của phản ứng toả nhiệt và thu nhiệt
Sơ đồ mô tả sự thay đổi enthalpy trong phản ứng tỏa nhiệt (giải phóng nhiệt) và phản ứng thu nhiệt (hấp thụ nhiệt).
Ứng Dụng Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Cung cấp năng lượng: Đốt cháy nhiên liệu để sản xuất điện, nhiệt cho sinh hoạt và công nghiệp.
- Sản xuất vật liệu: Phản ứng nhiệt nhôm được sử dụng để hàn đường ray, sản xuất kim loại.
- Sưởi ấm: Các loại lò sưởi, bếp sử dụng nhiên liệu đốt để tạo nhiệt.
- Công nghiệp hóa chất: Nhiều quy trình sản xuất hóa chất dựa trên các phản ứng tỏa nhiệt.
- Y học: Một số phản ứng tỏa nhiệt được sử dụng trong các thiết bị y tế.
Kết Luận
Phản ứng tỏa nhiệt là một phần quan trọng của hóa học và có vai trò thiết yếu trong cuộc sống. Hiểu rõ về khái niệm, đặc điểm và ứng dụng của phản ứng tỏa nhiệt giúp chúng ta khai thác hiệu quả nguồn năng lượng từ các phản ứng này, đồng thời đảm bảo an toàn trong quá trình sử dụng. Việc nghiên cứu và phát triển các phản ứng tỏa nhiệt mới, hiệu quả hơn sẽ góp phần giải quyết các vấn đề năng lượng và bảo vệ môi trường.
