Phản ứng Khử là một khái niệm quan trọng trong hóa học, đặc biệt trong chương trình hóa học lớp 10. Bài viết này sẽ cung cấp một cái nhìn toàn diện về phản ứng khử, bao gồm định nghĩa, dấu hiệu nhận biết, các loại phản ứng, ví dụ minh họa và bài tập vận dụng, giúp bạn nắm vững kiến thức và tự tin giải quyết các bài tập liên quan.
1. Định Nghĩa Phản Ứng Khử
Phản ứng khử (hay còn gọi là quá trình khử) là quá trình mà một chất nhận electron, dẫn đến sự giảm số oxi hóa của chất đó. Trong một phản ứng oxi hóa – khử hoàn chỉnh, luôn có đồng thời quá trình khử và quá trình oxi hóa diễn ra.
- Chất khử (chất bị oxi hóa): Là chất nhường electron, làm tăng số oxi hóa của mình.
- Chất oxi hóa (chất bị khử): Là chất nhận electron, làm giảm số oxi hóa của mình.
Ví dụ, trong phản ứng sau:
Fe + CuSO₄ → Cu + FeSO₄
- Fe là chất khử (Fe⁰ → Fe²⁺ + 2e)
- CuSO₄ là chất oxi hóa (Cu²⁺ + 2e → Cu⁰)
2. Dấu Hiệu Nhận Biết Phản Ứng Khử
Để nhận biết một phản ứng có phải là phản ứng khử hay không, ta cần dựa vào sự thay đổi số oxi hóa của các nguyên tố trong phản ứng.
- Dấu hiệu chính: Số oxi hóa của một nguyên tố giảm sau phản ứng. Điều này đồng nghĩa với việc chất chứa nguyên tố đó đã nhận electron, tức là đã xảy ra quá trình khử.
Ví dụ:
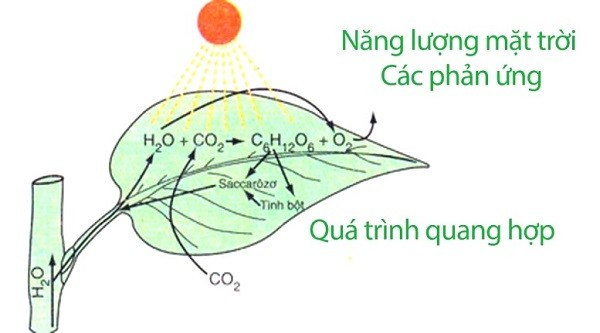
- Quá trình quang hợp ở cây xanh: CO₂ được khử thành glucose (C₆H₁₂O₆).
- Sự đốt cháy nhiên liệu: O₂ oxi hóa nhiên liệu, đồng thời O₂ bị khử.
- Các quá trình điện phân, phản ứng trong pin.
3. Các Bước Cân Bằng Phương Trình Phản Ứng Khử
Để cân bằng một phương trình phản ứng khử, ta thực hiện theo các bước sau:
Bước 1: Xác định số oxi hóa của tất cả các nguyên tố trong phản ứng. Xác định chất khử và chất oxi hóa.
Bước 2: Viết quá trình oxi hóa (nhường electron) và quá trình khử (nhận electron). Cân bằng số lượng nguyên tử và điện tích trong mỗi quá trình.
Bước 3: Nhân hệ số thích hợp vào mỗi quá trình sao cho tổng số electron nhường bằng tổng số electron nhận.
Bước 4: Đặt các hệ số vừa tìm được vào phương trình phản ứng và cân bằng lại phương trình.
4. Các Loại Phản Ứng Khử Phổ Biến
Có nhiều loại phản ứng khử khác nhau, có thể phân loại dựa trên đặc điểm của chất oxi hóa và chất khử:
-
Phản ứng oxi hóa – khử thông thường: Chất oxi hóa và chất khử thuộc về các phân tử khác nhau.
Ví dụ: C + 4HNO₃ (đặc) → CO₂ + 4NO₂ + 2H₂O
-
Phản ứng oxi hóa – khử nội phân tử: Chất oxi hóa và chất khử cùng thuộc một phân tử, nhưng ở các nguyên tử khác nhau.
Ví dụ: NH₄NO₂ → N₂ + 2H₂O
-
Phản ứng tự oxi hóa – khử: Một chất vừa là chất oxi hóa, vừa là chất khử.
Ví dụ: Cl₂ + 2KOH → KCl + KClO + H₂O
5. Ví Dụ Về Phản Ứng Khử và Xác Định Số Oxi Hóa
Để hiểu rõ hơn về phản ứng khử, ta xét một số ví dụ cụ thể:
Ví dụ 1: Phản ứng giữa Al và HNO₃
Al + HNO₃ → Al(NO₃)₃ + NO + H₂O (chưa cân bằng)
- Al là chất khử (Al⁰ → Al³⁺ + 3e)
- HNO₃ là chất oxi hóa (N⁵⁺ + 3e → N²⁺)
Ví dụ 2: Phản ứng giữa KMnO₄ và HCl
KMnO₄ + HCl → KCl + MnCl₂ + Cl₂ + H₂O (chưa cân bằng)
- KMnO₄ là chất oxi hóa (Mn⁷⁺ + 5e → Mn²⁺)
- HCl là chất khử (2Cl⁻ → Cl₂ + 2e)
Ví dụ 3: Phản ứng giữa Cu và H₂SO₄
Cu + H₂SO₄ → CuSO₄ + SO₂ + H₂O (chưa cân bằng)
- Cu là chất khử (Cu⁰ → Cu²⁺ + 2e)
- H₂SO₄ là chất oxi hóa (S⁶⁺ + 2e → S⁴⁺)
6. Bài Tập Vận Dụng Về Phản Ứng Khử (Hóa Học Lớp 10)
Để củng cố kiến thức về phản ứng khử, hãy cùng giải một số bài tập sau:
Bài tập 1: Cho các phản ứng sau, xác định phản ứng nào là phản ứng oxi hóa – khử:
a) CaCO₃ → CaO + CO₂
b) 2HgO → 2Hg + O₂
c) NaOH + HCl → NaCl + H₂O
Lời giải:
Chỉ có phản ứng b) là phản ứng oxi hóa – khử, vì có sự thay đổi số oxi hóa của Hg và O.
Bài tập 2: Trong phản ứng sau, NH₃ đóng vai trò là chất gì?
4NH₃ + 5O₂ → 4NO + 6H₂O
Lời giải:
Trong phản ứng này, NH₃ là chất khử (N⁻³ → N⁺² + 5e).
Bài tập 3: Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 100ml dung dịch AgNO₃ 0,2M?
Lời giải:
- n(AgNO₃) = 0,2 mol/l * 0,1 l = 0,02 mol
- Phương trình phản ứng: Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag
- n(Cu) = 1/2 * n(AgNO₃) = 0,01 mol
- m(Cu) = 0,01 mol * 64 g/mol = 0,64 g
Bài tập 4: Cân bằng phương trình phản ứng sau bằng phương pháp thăng bằng electron:
KMnO₄ + FeSO₄ + H₂SO₄ → Fe₂(SO₄)₃ + MnSO₄ + K₂SO₄ + H₂O
7. Kết Luận
Phản ứng khử là một phần kiến thức quan trọng trong chương trình hóa học, đặc biệt là hóa học lớp 10. Việc nắm vững khái niệm, dấu hiệu nhận biết và các bước cân bằng phương trình phản ứng khử sẽ giúp bạn tự tin hơn trong học tập và giải quyết các bài tập liên quan. Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn tổng quan và chi tiết về phản ứng khử.