Nồng độ Dung Dịch là một khái niệm quan trọng trong hóa học và có ứng dụng rộng rãi trong đời sống hàng ngày, từ việc pha chế đồ uống đến các quy trình sản xuất công nghiệp. Hiểu rõ về nồng độ dung dịch giúp chúng ta kiểm soát được thành phần và tính chất của các hỗn hợp, đảm bảo hiệu quả và an toàn khi sử dụng. Bài viết này sẽ cung cấp một cái nhìn tổng quan về các loại nồng độ dung dịch phổ biến, cách tính toán và ứng dụng của chúng.
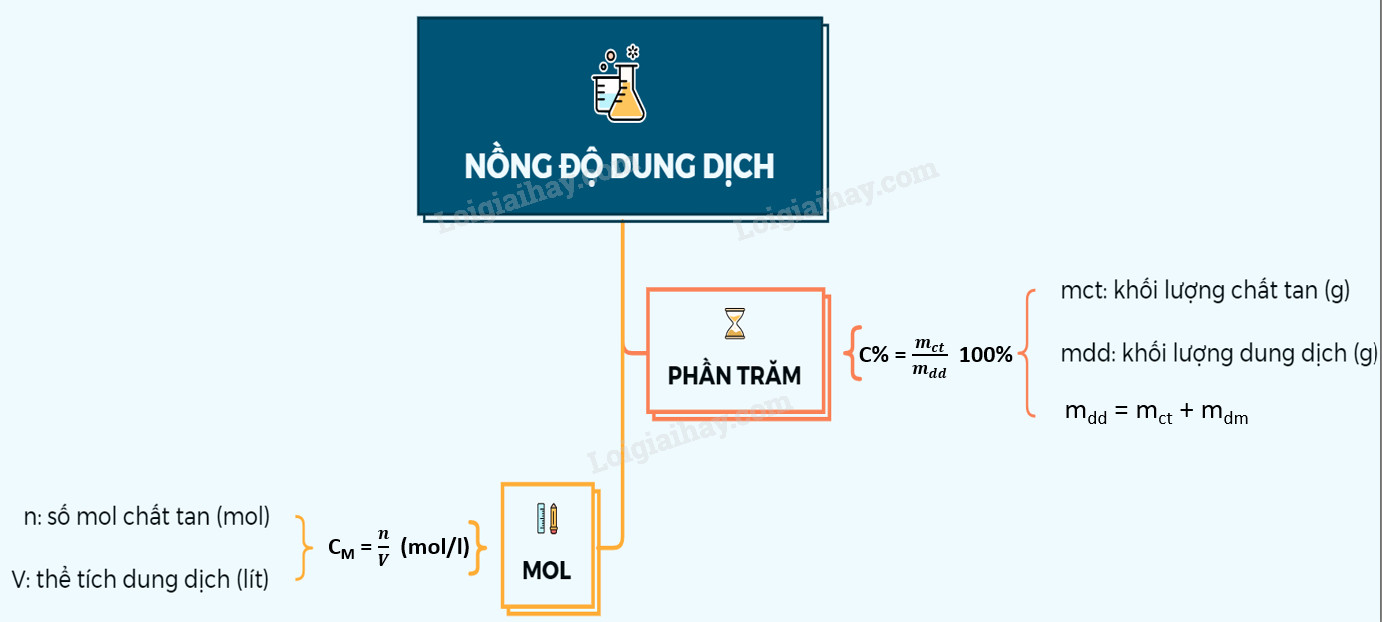
Nồng Độ Phần Trăm (C%)
Nồng độ phần trăm, ký hiệu là C%, cho biết số gam chất tan có trong 100 gam dung dịch. Đây là một cách biểu thị nồng độ đơn giản và dễ hiểu, thường được sử dụng trong các ứng dụng thực tế.
Công thức tính:
$C% = frac{m{ct}}{m{dd}} times 100%$
Trong đó:
- C%: Nồng độ phần trăm của dung dịch (%).
- $m_{ct}$: Khối lượng chất tan (gam).
- $m{dd}$: Khối lượng dung dịch (gam). Lưu ý: $m{dd}$ = $m{dung môi}$ + $m{chất tan}$.
Ví dụ: Hòa tan 20 gam muối ăn vào 80 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Giải:
- Khối lượng chất tan (muối ăn): $m_{ct}$ = 20 gam
- Khối lượng dung dịch: $m_{dd}$ = 20 gam + 80 gam = 100 gam
- Nồng độ phần trăm của dung dịch: $C% = frac{20}{100} times 100% = 20%$
Công thức nồng độ phần trăm giúp chúng ta xác định hàm lượng chất tan trong dung dịch, từ đó kiểm soát được độ đậm đặc và các đặc tính liên quan.
Các công thức suy ra:
- Khối lượng dung dịch: $m{dd} = frac{m{ct} times 100%}{C%}$
- Khối lượng chất tan: $m{ct} = frac{m{dd} times C%}{100%}$
Nồng Độ Mol (CM)
Nồng độ mol, ký hiệu là CM, cho biết số mol chất tan có trong một lít dung dịch. Đây là một cách biểu thị nồng độ phổ biến trong hóa học, đặc biệt khi liên quan đến các phản ứng hóa học.
Công thức tính:
$CM = frac{n}{V{dd}}$
Trong đó:
- $C_M$: Nồng độ mol (mol/L hoặc M).
- n: Số mol chất tan (mol).
- $V_{dd}$: Thể tích dung dịch (lít).
Ví dụ: Hòa tan 0.5 mol đường vào nước để tạo thành 2 lít dung dịch. Tính nồng độ mol của dung dịch thu được.
Giải:
- Số mol chất tan (đường): n = 0.5 mol
- Thể tích dung dịch: $V_{dd}$ = 2 lít
- Nồng độ mol của dung dịch: $C_M = frac{0.5}{2} = 0.25 M$
Các công thức suy ra:
- Số mol chất tan: n = $CM times V{dd}$
- Thể tích dung dịch: $V_{dd} = frac{n}{C_M}$
Nồng độ mol cho phép chúng ta tính toán chính xác lượng chất tan cần thiết cho một phản ứng hóa học, đảm bảo hiệu suất và độ tin cậy của thí nghiệm.
Mối Liên Hệ Giữa Nồng Độ Phần Trăm và Nồng Độ Mol
Trong nhiều trường hợp, chúng ta cần chuyển đổi giữa nồng độ phần trăm và nồng độ mol. Để thực hiện việc này, chúng ta cần biết khối lượng riêng của dung dịch.
Công thức chuyển đổi:
$CM = frac{C% times D{dd} times 10}{M}$
Trong đó:
- $C_M$: Nồng độ mol (mol/L).
- C%: Nồng độ phần trăm (%).
- $D_{dd}$: Khối lượng riêng của dung dịch (g/mL).
- M: Khối lượng mol của chất tan (g/mol).
Lưu ý: Đảm bảo đơn vị của các đại lượng phải thống nhất trước khi áp dụng công thức.
Ví dụ: Dung dịch H2SO4 10% có khối lượng riêng là 1.07 g/mL. Tính nồng độ mol của dung dịch này.
Giải:
- C% = 10%
- $D_{dd}$ = 1.07 g/mL
- M (H2SO4) = 98 g/mol
- $C_M = frac{10 times 1.07 times 10}{98} approx 1.09 M$
Hiểu rõ công thức chuyển đổi giữa nồng độ phần trăm và nồng độ mol giúp chúng ta linh hoạt hơn trong việc tính toán và ứng dụng các kiến thức về nồng độ dung dịch.
Ứng Dụng Của Nồng Độ Dung Dịch
Nồng độ dung dịch có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Trong phòng thí nghiệm: Pha chế các dung dịch chuẩn để thực hiện các thí nghiệm hóa học và phân tích.
- Trong y học: Điều chế thuốc và dung dịch tiêm truyền với nồng độ chính xác để đảm bảo an toàn và hiệu quả điều trị.
- Trong công nghiệp thực phẩm: Kiểm soát nồng độ các chất phụ gia, hương liệu và chất bảo quản để đảm bảo chất lượng và an toàn thực phẩm.
- Trong nông nghiệp: Pha chế dung dịch phân bón và thuốc bảo vệ thực vật với nồng độ phù hợp để tăng năng suất cây trồng và bảo vệ mùa màng.
Nắm vững kiến thức về nồng độ dung dịch là vô cùng quan trọng để ứng dụng thành công trong các lĩnh vực này.