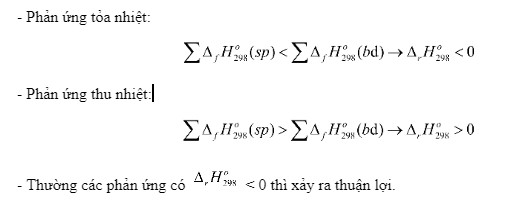Enthalpy của phản ứng (hay còn gọi là nhiệt phản ứng), ký hiệu là ∆rH, thường được đo bằng đơn vị kJ hoặc kcal. Đây là thước đo sự thay đổi nhiệt trong một phản ứng hóa học xảy ra ở áp suất không đổi (quá trình đẳng áp).
Biến thiên enthalpy chuẩn, hay nhiệt phản ứng chuẩn, ký hiệu là ({Delta r}H{298}^o), thể hiện lượng nhiệt tỏa ra hoặc hấp thụ khi phản ứng diễn ra trong điều kiện chuẩn. Điều kiện chuẩn được quy định là áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25°C (298 K).
Phương trình nhiệt hóa học là phương trình phản ứng hóa học, trong đó bao gồm cả nhiệt phản ứng và trạng thái vật lý của các chất tham gia (chất đầu) và sản phẩm.
Nhiệt Tạo Thành (Enthalpy Tạo Thành)
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền vững nhất ở điều kiện chuẩn.
Nhiệt tạo thành trong điều kiện chuẩn được gọi là Nhiệt Tạo Thành Tiêu Chuẩn và ký hiệu là ({Delta f}H{298}^o). Giá trị này là một đại lượng rất quan trọng trong hóa học nhiệt động lực, cho phép chúng ta tính toán và dự đoán sự thay đổi enthalpy của các phản ứng hóa học khác nhau.
Phản ứng thu nhiệt là phản ứng hấp thụ nhiệt từ môi trường xung quanh ( ({Delta r}H{298}^o) > 0). Phản ứng tỏa nhiệt là phản ứng giải phóng nhiệt ra môi trường xung quanh (({Delta r}H{298}^o) < 0). Dấu và giá trị của ({Delta r}H{298}^o) cho biết phản ứng tỏa nhiệt hay thu nhiệt và lượng nhiệt tương ứng.
Ứng dụng của Nhiệt Tạo Thành Tiêu Chuẩn
Nhiệt tạo thành tiêu chuẩn được sử dụng rộng rãi để tính toán biến thiên enthalpy của các phản ứng hóa học. Nó giúp dự đoán tính khả thi của phản ứng và cung cấp thông tin quan trọng cho nhiều lĩnh vực khác nhau, bao gồm:
- Công nghiệp hóa chất: Tính toán nhiệt lượng cần thiết cho các quy trình sản xuất.
- Năng lượng: Nghiên cứu và phát triển các nguồn năng lượng mới.
- Môi trường: Đánh giá tác động của các phản ứng hóa học đến môi trường.
Cách Tính Biến Thiên Enthalpy của Phản Ứng Dựa Trên Nhiệt Tạo Thành Tiêu Chuẩn
Biến thiên enthalpy của một phản ứng có thể được tính toán bằng cách sử dụng nhiệt tạo thành tiêu chuẩn của các chất phản ứng và sản phẩm. Công thức tổng quát là:
∆rHo = Σ∆fHo(sản phẩm) – Σ∆fHo(chất phản ứng)
Trong đó:
- ∆rHo là biến thiên enthalpy chuẩn của phản ứng.
- Σ∆fHo(sản phẩm) là tổng nhiệt tạo thành tiêu chuẩn của tất cả các sản phẩm, nhân với hệ số tỉ lượng tương ứng.
- Σ∆fHo(chất phản ứng) là tổng nhiệt tạo thành tiêu chuẩn của tất cả các chất phản ứng, nhân với hệ số tỉ lượng tương ứng.
Lưu ý rằng nhiệt tạo thành tiêu chuẩn của các đơn chất ở dạng bền vững nhất của chúng bằng 0.
Hiểu rõ về nhiệt tạo thành tiêu chuẩn là rất quan trọng để nắm vững các khái niệm cơ bản trong hóa học nhiệt động lực và ứng dụng chúng vào thực tế.