Trong hóa học, năng lượng đóng vai trò then chốt trong mọi phản ứng. Một khái niệm quan trọng để hiểu rõ sự thay đổi năng lượng trong các phản ứng là nhiệt tạo thành. Vậy, chính xác Nhiệt Tạo Thành Là Gì? Bài viết này sẽ cung cấp một cái nhìn toàn diện về khái niệm này, từ định nghĩa, cách tính toán đến ứng dụng thực tế.
1. Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Trước khi đi sâu vào nhiệt tạo thành là gì, chúng ta cần phân biệt hai loại phản ứng hóa học cơ bản dựa trên sự thay đổi nhiệt:
-
Phản ứng tỏa nhiệt: Là phản ứng giải phóng năng lượng dưới dạng nhiệt ra môi trường xung quanh. Trong phản ứng này, enthalpy (ΔH) có giá trị âm (ΔH < 0).
-
Phản ứng thu nhiệt: Là phản ứng hấp thụ năng lượng từ môi trường xung quanh để xảy ra. Trong phản ứng này, enthalpy (ΔH) có giá trị dương (ΔH > 0).
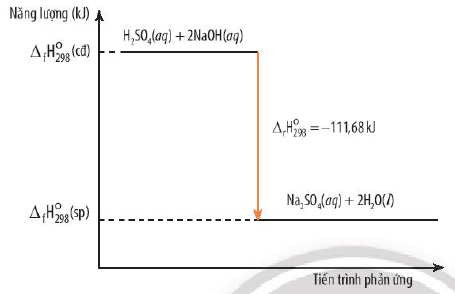 Phân biệt phản ứng tỏa nhiệt và thu nhiệt dựa trên sự thay đổi enthalpy
Phân biệt phản ứng tỏa nhiệt và thu nhiệt dựa trên sự thay đổi enthalpy
Hình ảnh minh họa sự khác biệt giữa phản ứng tỏa nhiệt và thu nhiệt, chú trọng vào sự thay đổi mức năng lượng và dấu của ΔH.
2. Định Nghĩa Nhiệt Tạo Thành
Nhiệt tạo thành (hay còn gọi là enthalpy tạo thành) của một chất là lượng nhiệt tỏa ra hoặc thu vào khi tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
- Ký hiệu: ΔHfo (thường được tính theo đơn vị kJ/mol hoặc kcal/mol)
- Điều kiện tiêu chuẩn: Áp suất 1 bar (100 kPa) và nhiệt độ 25°C (298 K).
- Đơn chất bền nhất: Là dạng tồn tại ổn định nhất của một nguyên tố ở điều kiện tiêu chuẩn (ví dụ: carbon ở dạng graphite, oxygen ở dạng khí O2).
3. Nhiệt Tạo Thành Chuẩn
Nhiệt tạo thành chuẩn (ΔHf,298o) là nhiệt tạo thành được đo ở điều kiện tiêu chuẩn (298 K và 1 bar). Giá trị này thường được sử dụng để tính toán sự thay đổi enthalpy của các phản ứng khác.
Ví dụ:
ΔHf,298o (CO2, g) = -393.5 kJ/mol
Điều này có nghĩa là khi tạo thành 1 mol khí CO2 từ carbon (graphite) và oxygen (O2) ở điều kiện tiêu chuẩn, sẽ có 393.5 kJ nhiệt được giải phóng ra môi trường (phản ứng tỏa nhiệt).
Phương trình nhiệt hóa học minh họa:
C (graphite) + O2 (g) → CO2 (g) ΔHf,298o = -393.5 kJ/mol
4. Ý Nghĩa của Nhiệt Tạo Thành
Giá trị của nhiệt tạo thành cung cấp thông tin quan trọng về độ bền nhiệt động của một chất:
-
ΔHfo < 0: Chất bền về mặt năng lượng hơn so với các đơn chất tạo thành nó. Điều này có nghĩa là để tạo thành chất đó, năng lượng đã được giải phóng.
-
ΔHfo > 0: Chất kém bền về mặt năng lượng hơn so với các đơn chất tạo thành nó. Cần cung cấp năng lượng để tạo thành chất đó.
5. Cách Tính Nhiệt Phản Ứng Sử Dụng Nhiệt Tạo Thành
Nhiệt tạo thành là công cụ hữu ích để tính toán biến thiên enthalpy của một phản ứng (ΔHrxno). Công thức tổng quát như sau:
ΔHrxno = ∑ ΔHfo (sản phẩm) – ∑ ΔHfo (chất phản ứng)
Trong đó:
- ∑ ΔHfo (sản phẩm) là tổng nhiệt tạo thành của tất cả các sản phẩm, có xét đến hệ số tỷ lượng của chúng.
- ∑ ΔHfo (chất phản ứng) là tổng nhiệt tạo thành của tất cả các chất phản ứng, có xét đến hệ số tỷ lượng của chúng.
Lưu ý quan trọng: Nhiệt tạo thành của một đơn chất ở dạng bền nhất ở điều kiện tiêu chuẩn luôn bằng 0.
Công thức hóa học thể hiện cách tính enthalpy phản ứng từ nhiệt tạo thành của sản phẩm và chất phản ứng.
6. Ví Dụ Minh Họa
Xét phản ứng đốt cháy methane (CH4):
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)
Để tính ΔHrxno, ta cần biết nhiệt tạo thành chuẩn của các chất tham gia và sản phẩm:
- ΔHf,298o (CH4, g) = -74.8 kJ/mol
- ΔHf,298o (O2, g) = 0 kJ/mol (đơn chất bền nhất)
- ΔHf,298o (CO2, g) = -393.5 kJ/mol
- ΔHf,298o (H2O, g) = -241.8 kJ/mol
Áp dụng công thức:
ΔHrxno = [1(-393.5) + 2(-241.8)] – [1(-74.8) + 2(0)] = -802.3 kJ/mol
Vậy, phản ứng đốt cháy methane tỏa ra 802.3 kJ nhiệt mỗi mol CH4 bị đốt cháy.
7. Ứng Dụng Của Nhiệt Tạo Thành
-
Dự đoán nhiệt của phản ứng: Tính toán ΔHrxno giúp dự đoán phản ứng tỏa nhiệt hay thu nhiệt, và lượng nhiệt liên quan.
-
Đánh giá độ bền của hợp chất: So sánh nhiệt tạo thành của các hợp chất tương tự giúp đánh giá độ bền tương đối của chúng.
-
Nghiên cứu nhiệt động lực học: Nhiệt tạo thành là một thông số quan trọng trong các tính toán nhiệt động lực học để xác định tính khả thi của một phản ứng.
-
Công nghiệp hóa chất: Sử dụng trong thiết kế và tối ưu hóa các quy trình hóa học, đảm bảo an toàn và hiệu quả năng lượng.
Kết Luận
Hiểu rõ nhiệt tạo thành là gì là nền tảng quan trọng trong hóa học. Nó không chỉ giúp chúng ta dự đoán sự thay đổi năng lượng trong các phản ứng mà còn cung cấp thông tin quan trọng về độ bền của các chất và là công cụ không thể thiếu trong nhiều lĩnh vực khoa học và công nghiệp. Nắm vững kiến thức này sẽ giúp bạn giải quyết các bài toán liên quan đến nhiệt động lực học và hiểu sâu sắc hơn về thế giới hóa học xung quanh ta.