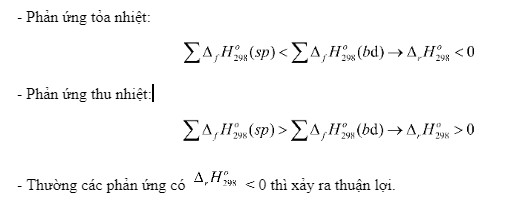Enthalpy là một khái niệm quan trọng trong hóa học, đặc biệt là trong lĩnh vực nhiệt động lực học. Để hiểu rõ về các phản ứng hóa học và quá trình biến đổi năng lượng, chúng ta cần nắm vững khái niệm về “nhiệt tạo thành chuẩn”. Vậy, Nhiệt Tạo Thành Chuẩn Là Gì và nó có ý nghĩa như thế nào trong hóa học? Bài viết này sẽ cung cấp một cái nhìn toàn diện về chủ đề này.
1. Định nghĩa Enthalpy và Biến Thiên Enthalpy
Trước khi đi sâu vào “nhiệt tạo thành chuẩn”, chúng ta cần hiểu rõ về enthalpy (H) và biến thiên enthalpy (ΔH).
- Enthalpy (H): Là một hàm trạng thái nhiệt động học, biểu thị tổng năng lượng bên trong của một hệ thống cộng với tích của áp suất và thể tích của nó. Enthalpy thường được sử dụng để mô tả các phản ứng hóa học xảy ra ở áp suất không đổi.
- Biến thiên Enthalpy (ΔH): Là sự thay đổi enthalpy của một hệ thống trong một quá trình hóa học hoặc vật lý. ΔH cho biết lượng nhiệt mà hệ thống hấp thụ hoặc giải phóng trong quá trình đó. Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu ∆rH, thường tính theo đơn vị kJ hoặc kcal. Biến thiên enthalpy của phản ứng là lượng nhiệt tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
2. Biến Thiên Enthalpy Chuẩn (Nhiệt Phản Ứng Chuẩn)
Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu là ({Delta _r}H_{298}^o), là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn. Điều kiện chuẩn được quy định như sau:
- Áp suất: 1 bar (đối với chất khí)
- Nồng độ: 1 mol/L (đối với chất tan trong dung dịch)
- Nhiệt độ: Thường chọn 25°C (298 K), mặc dù nhiệt độ có thể được chỉ định khác.
3. Enthalpy Tạo Thành (Nhiệt Tạo Thành)
Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
4. Nhiệt Tạo Thành Chuẩn Là Gì?
Nhiệt tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là ({Delta _f}H_{298}^o). Nó thể hiện lượng nhiệt tỏa ra hoặc thu vào khi một mol của một chất được tạo thành từ các đơn chất bền nhất của nó ở điều kiện chuẩn (298K và 1 bar).
Alt text: Biểu đồ so sánh năng lượng của chất tham gia và sản phẩm trong phản ứng tỏa nhiệt và thu nhiệt, minh họa ý nghĩa của ΔH trong việc xác định loại phản ứng.
Ví dụ:
- Nhiệt tạo thành chuẩn của nước lỏng (H₂O(l)) là -285.8 kJ/mol. Điều này có nghĩa là khi một mol nước lỏng được tạo thành từ khí hydro (H₂) và khí oxy (O₂) ở điều kiện chuẩn, phản ứng giải phóng 285.8 kJ nhiệt.
5. Ý Nghĩa của Nhiệt Tạo Thành Chuẩn
Nhiệt tạo thành chuẩn là một đại lượng nhiệt động quan trọng, có nhiều ứng dụng trong hóa học và các lĩnh vực liên quan:
- Tính toán biến thiên enthalpy của phản ứng: Có thể sử dụng nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm để tính toán biến thiên enthalpy chuẩn của một phản ứng bất kỳ.
Công thức: ΔH°r = ΣΔH°f(sản phẩm) – ΣΔH°f(chất phản ứng) - Đánh giá tính bền của hợp chất: Các hợp chất có nhiệt tạo thành chuẩn âm (ΔH°f < 0) thường bền hơn so với các đơn chất tạo thành chúng. Ngược lại, các hợp chất có nhiệt tạo thành chuẩn dương (ΔH°f > 0) thường kém bền hơn.
- Dự đoán chiều hướng của phản ứng: Mặc dù không phải là yếu tố duy nhất, nhiệt tạo thành chuẩn có thể giúp dự đoán chiều hướng ưu tiên của một phản ứng hóa học. Các phản ứng có xu hướng xảy ra theo chiều làm giảm năng lượng của hệ thống (tức là giải phóng nhiệt).
- Ứng dụng trong công nghiệp: Nhiệt tạo thành chuẩn được sử dụng trong nhiều quá trình công nghiệp, chẳng hạn như thiết kế lò phản ứng, tính toán hiệu suất năng lượng và tối ưu hóa các điều kiện phản ứng.
6. Phản Ứng Thu Nhiệt và Phản Ứng Tỏa Nhiệt
- Phản ứng thu nhiệt: là phản ứng hấp thụ nhiệt từ môi trường xung quanh. Trong phản ứng thu nhiệt, ({Delta _r}H_{298}^o) > 0.
- Phản ứng tỏa nhiệt: là phản ứng giải phóng nhiệt ra môi trường xung quanh. Trong phản ứng tỏa nhiệt, ({Delta _r}H_{298}^o) < 0.
7. Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp). Việc ghi rõ trạng thái của các chất là vô cùng quan trọng, vì enthalpy tạo thành của một chất phụ thuộc vào trạng thái vật lý của nó (rắn, lỏng, khí).
Alt text: Phương trình nhiệt hóa học của phản ứng đốt cháy methane (CH4) với oxygen (O2), tạo thành carbon dioxide (CO2) và nước (H2O), kèm theo giá trị ΔH < 0 biểu thị phản ứng tỏa nhiệt.
Kết luận
Nhiệt tạo thành chuẩn là một khái niệm cơ bản và quan trọng trong hóa học. Việc hiểu rõ về nhiệt tạo thành chuẩn giúp chúng ta nắm bắt được bản chất của các phản ứng hóa học, dự đoán chiều hướng và tính toán các thông số nhiệt động liên quan. Nó là một công cụ mạnh mẽ để nghiên cứu và ứng dụng các quá trình hóa học trong nhiều lĩnh vực khác nhau.