Nguyên tử và phân tử không phải lúc nào cũng liên kết với nhau bằng các liên kết hóa học mạnh như liên kết cộng hóa trị hay liên kết ion. Vậy, Nguyên Tử Có Khả Năng Liên Kết Với Nhau Nhờ những lực nào khác? Câu trả lời nằm ở các tương tác yếu hơn, trong đó có tương tác Van der Waals và liên kết Hydrogen. Bài viết này sẽ tập trung vào tương tác Van der Waals, một lực hút tĩnh điện yếu nhưng quan trọng giữa các nguyên tử và phân tử.
Tương Tác Van Der Waals Là Gì?
Ngay cả giữa các phân tử không có liên kết hydrogen, vẫn tồn tại khả năng tương tác với nhau, mặc dù yếu hơn. Tương tác này được gọi là tương tác Van der Waals. Nó là một tương tác tĩnh điện lưỡng cực-lưỡng cực giữa các nguyên tử hoặc phân tử.
Bản Chất Của Tương Tác Van Der Waals
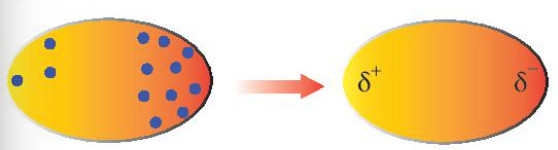
Electron trong phân tử luôn chuyển động. Khi các electron di chuyển tập trung về một phía của phân tử, sự chênh lệch điện tích sẽ hình thành, tạo ra các lưỡng cực tạm thời.
Các phân tử có lưỡng cực tạm thời có thể gây ra sự xuất hiện của lưỡng cực cảm ứng trong các phân tử lân cận. Do đó, các phân tử có thể tập hợp thành một mạng lưới nhờ tương tác lưỡng cực cảm ứng, tạo nên liên kết Van der Waals. Nguyên tử có khả năng liên kết với nhau nhờ lực hút tĩnh điện giữa các lưỡng cực này.
Ảnh Hưởng Của Tương Tác Van Der Waals Đến Tính Chất Vật Lý
Tương tác Van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất, mặc dù ảnh hưởng này yếu hơn so với liên kết hydrogen. Khi khối lượng phân tử và kích thước phân tử tăng, tương tác Van der Waals cũng tăng theo. Liên kết Van der Waals tăng theo sự tăng của số lượng electron trong phân tử.
Ví dụ, trong nhóm khí hiếm (VIIIA), theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử và khối lượng nguyên tử tăng, dẫn đến tương tác Van der Waals tăng. Do đó, nhiệt độ nóng chảy và nhiệt độ sôi cũng tăng. Nguyên tử có khả năng liên kết với nhau nhờ lực Van der Waals, và lực này ảnh hưởng trực tiếp đến các tính chất vĩ mô của vật chất.
Mặc dù tương tác Van der Waals yếu, nhưng nó có ảnh hưởng lớn đến thực tiễn. Ví dụ, nó giải thích sự bám hút của hạt bụi lên bề mặt nhẵn, hoặc sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính.
Bài Tập Củng Cố Về Liên Kết Van Der Waals
Câu 1: Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì, tạo nên sự chênh lệch điện tích, sẽ hình thành nên các:
A. Lưỡng cực tạm thời
B. Lưỡng cực cảm ứng
C. Lưỡng cực vĩnh viễn
D. Một ion âm
Câu 2: Tương tác Van der Waals là lực tương tác yếu giữa các phân tử, được hình thành nhờ sự xuất hiện của các:
A. Ion âm và ion dương
B. Lưỡng cực tạm thời
C. Lưỡng cực cảm ứng
D. Cả B và C
Câu 3: Tương tác Van der Waals làm:
A. Giảm nhiệt độ sôi và nhiệt độ nóng chảy của các chất
B. Giảm nhiệt độ sôi và tăng nhiệt độ nóng chảy của các chất
C. Tăng nhiệt độ sôi và giảm nhiệt độ nóng chảy của các chất
D. Tăng nhiệt độ sôi và nhiệt độ nóng chảy của các chất
Câu 4: Bản chất của hình thành liên kết hydrogen và tương tác Van der Waals đều do:
A. Sự góp chung electron
B. Sự nhường – nhận electron
C. Tương tác hút tĩnh điện
D. Cả 3 đáp án A, B và C đều sai
Câu 5: Khí hiếm nào sau đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Câu 6: Liên kết Van der Waals tăng khi:
A. Khối lượng phân tử tăng và kích thước phân tử tăng
B. Khối lượng phân tử giảm và kích thước phân tử giảm
C. Khối lượng phân tử tăng và kích thước phân tử giảm
D. Khối lượng phân tử giảm và kích thước phân tử tăng
Câu 7: Cho các phát biểu sau:
(1) Liên kết hydrogen yếu hơn cả liên kết ion và liên kết cộng hóa trị.
(2) Liên kết hydrogen mạnh hơn cả liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn so với liên kết hydrogen.
(4) Tương tác van der waals mạnh hơn so với liên kết hydrogen.
Những phát biểu đúng là:
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Câu 8: Một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cực trái dấu của phân tử là:
A. Tương tác Van der Waals
B. Liên kết hydrogen
C. Liên kết ion
D. Liên kết cộng hóa trị
Câu 9: Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine tồn tại ở dạng chất khí còn bromine là chất lỏng. Đó là do:
A. Khối lượng phân tử bromine lớn hơn.
B. Ở trạng thái lỏng, giữa các phân tử bromine tồn tại một loại tương tác yếu, đó là tương tác Van der Waals.
C. Ở trạng thái lỏng, giữa các phân tử bromine tồn tại một loại tương tác yếu, đó là liên kết hydrogen.
D. Kích thước phân tử bromine lớn hơn.
Câu 10: Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên khi ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Đó là do:
A. Đặc điểm nguyên tử khí hiếm có cấu hình electron bền vững.
B. Nguyên tử khí hiếm khó có thể tham gia vào các phản ứng hóa học.
C. Ở nhiệt độ thấp, giữa các nguyên tử khí hiếm hình thành một loại tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng.
D. Ở nhiệt độ thấp, giữa các nguyên tử khí hiếm có thể liên kết với nhau nhờ liên kết hydrogen.
Bảng đáp án tham khảo:
| Câu 1: A | Câu 2: D | Câu 3: D | Câu 4: C | Câu 5: A |
|---|---|---|---|---|
| Câu 6: A | Câu 7: A | Câu 8: A | Câu 9: B | Câu 10: C |
Thông qua bài viết này, hy vọng bạn đã hiểu rõ hơn về tương tác Van der Waals và vai trò của nó trong việc giải thích nhiều hiện tượng tự nhiên. Nguyên tử có khả năng liên kết với nhau nhờ không chỉ các liên kết mạnh mà còn cả những tương tác yếu như Van der Waals, và việc hiểu rõ những tương tác này là chìa khóa để nắm vững kiến thức hóa học.

