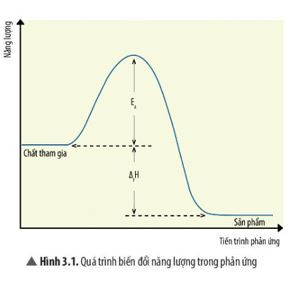
Trong hóa học, năng lượng hoạt hóa (Ea) đóng vai trò then chốt, quyết định liệu một phản ứng có thể xảy ra hay không và với tốc độ như thế nào. Năng lượng hoạt hóa là rào cản năng lượng mà các chất phản ứng phải vượt qua để chuyển đổi thành sản phẩm.
Năng lượng hoạt hóa càng cao, phản ứng càng khó xảy ra, bởi vì chỉ một lượng nhỏ các phân tử có đủ năng lượng để vượt qua rào cản này. Ngược lại, năng lượng hoạt hóa càng thấp, phản ứng xảy ra càng dễ dàng và nhanh chóng.
Mối quan hệ giữa Năng Lượng Hoạt Hóa và Tốc Độ Phản Ứng
Mối liên hệ giữa năng lượng hoạt hóa và tốc độ phản ứng được thể hiện rõ ràng thông qua phương trình Arrhenius:
k = A * e^(-Ea/RT)
Trong đó:
- k là hằng số tốc độ phản ứng
- A là thừa số tần số, liên quan đến tần số va chạm giữa các phân tử
- Ea là năng lượng hoạt hóa
- R là hằng số khí lý tưởng
- T là nhiệt độ (K)
Phương trình này cho thấy tốc độ phản ứng (k) tỉ lệ nghịch với năng lượng hoạt hóa (Ea). Khi năng lượng hoạt hóa tăng, số mũ âm trở nên lớn hơn, dẫn đến hằng số tốc độ (k) giảm và phản ứng diễn ra chậm hơn.
Ảnh Hưởng của Chất Xúc Tác đến Năng Lượng Hoạt Hóa
Chất xúc tác là những chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chúng hoạt động bằng cách giảm năng lượng hoạt hóa của phản ứng. Chất xúc tác tạo ra một con đường phản ứng mới với rào cản năng lượng thấp hơn, cho phép nhiều phân tử hơn có đủ năng lượng để phản ứng.
Ví dụ, enzyme lactase hoạt động như một chất xúc tác trong quá trình chuyển hóa lactose. Khi có enzyme lactase, năng lượng hoạt hóa cần thiết để chuyển hóa lactose giảm xuống, làm tăng tốc độ phản ứng và giúp cơ thể dễ dàng hấp thu glucose và galactose.
Ảnh Hưởng của Nhiệt Độ đến Tốc Độ Phản Ứng
Nhiệt độ có ảnh hưởng đáng kể đến tốc độ phản ứng. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn và có nhiều năng lượng hơn. Điều này dẫn đến số lượng va chạm giữa các phân tử tăng lên và quan trọng hơn, một phần lớn hơn các phân tử có đủ năng lượng để vượt qua rào cản năng lượng hoạt hóa. Do đó, tốc độ phản ứng thường tăng khi nhiệt độ tăng.
Ứng Dụng của Năng Lượng Hoạt Hóa trong Thực Tế
Hiểu biết về năng lượng hoạt hóa có nhiều ứng dụng thực tế, bao gồm:
- Công nghiệp hóa chất: Sử dụng chất xúc tác để tăng tốc độ phản ứng và giảm chi phí sản xuất. Ví dụ, V2O5 được sử dụng làm chất xúc tác trong quá trình tổng hợp SO3 từ SO2 và O2.
- Thực phẩm: Sử dụng enzyme để làm mềm thịt hoặc cải thiện quá trình tiêu hóa. Ví dụ, enzyme bromelain trong dứa giúp phân giải protein trong thịt, làm cho thịt mềm hơn.
- Y học: Phát triển các loại thuốc hoạt động bằng cách ức chế hoặc kích hoạt các enzyme, ảnh hưởng đến tốc độ các phản ứng sinh hóa trong cơ thể.
Trong tóm tắt, năng lượng hoạt hóa là một khái niệm quan trọng trong hóa học, ảnh hưởng trực tiếp đến tốc độ phản ứng. Việc hiểu và kiểm soát năng lượng hoạt hóa là chìa khóa để tối ưu hóa các quá trình hóa học và sinh học trong nhiều lĩnh vực khác nhau.