Phản ứng khử oxit sắt bằng H2 là một trong những phản ứng quan trọng trong hóa học vô cơ, đặc biệt trong luyện kim và các bài toán liên quan đến sắt và hợp chất của nó. Bài viết này sẽ đi sâu vào việc giải quyết các bài toán về Khử Hoàn Toàn M Gam Hỗn Hợp X Gồm Feo Và Fe2o3 Bằng H2, cung cấp các ví dụ minh họa và bài tập vận dụng.
Cơ Sở Lý Thuyết
Khi khử hỗn hợp FeO và Fe2O3 bằng H2, các phản ứng xảy ra như sau:
- FeO + H2 → Fe + H2O
- Fe2O3 + 3H2 → 2Fe + 3H2O
Tổng quát, quá trình khử oxit sắt bằng H2 tạo ra sắt (Fe) và nước (H2O). Lượng H2O tạo thành phụ thuộc vào số mol của các oxit sắt trong hỗn hợp ban đầu.
Ví Dụ Minh Họa
Ví dụ 1: Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (dư), thu được 9 gam H2O và 22,4 gam chất rắn. Tính phần trăm số mol của FeO trong hỗn hợp X.
Giải:
Đầu tiên, tính số mol của H2O: n(H2O) = 9/18 = 0,5 mol
Gọi số mol của FeO là x và số mol của Fe2O3 là y. Ta có các phương trình phản ứng:
- FeO + H2 → Fe + H2O (1)
x x - Fe2O3 + 3H2 → 2Fe + 3H2O (2)
y 3y
Từ (1) và (2), ta có hệ phương trình:
- x + 3y = 0,5 (theo số mol H2O)
- 56x + 112y = 22,4 (theo khối lượng Fe)
Giải hệ phương trình trên, ta được: x = 0,2 mol và y = 0,1 mol.
Phần trăm số mol của FeO trong hỗn hợp X là: %FeO = (0,2 / (0,2 + 0,1)) * 100% = 66,67%
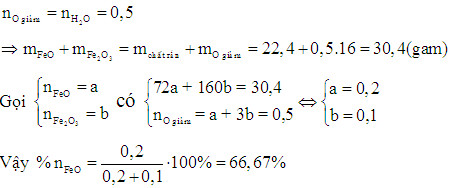 Phản ứng khử oxit sắt bằng H2 tạo thành Fe và H2O
Phản ứng khử oxit sắt bằng H2 tạo thành Fe và H2O
Hình ảnh minh họa phản ứng hóa học khử oxit sắt FeO và Fe2O3 bằng khí hidro (H2), tạo ra sắt (Fe) kim loại và nước (H2O).
Các Bước Giải Bài Toán Khử Oxit Sắt Bằng H2
- Xác định dữ kiện bài toán: Đọc kỹ đề bài, xác định các chất tham gia phản ứng, sản phẩm và các thông số đã cho (khối lượng, thể tích, số mol).
- Viết phương trình phản ứng: Viết các phương trình hóa học của phản ứng khử oxit sắt bằng H2.
- Tính số mol các chất: Tính số mol của các chất đã biết (ví dụ: H2O, Fe).
- Thiết lập hệ phương trình: Dựa vào các phương trình phản ứng và dữ kiện bài toán, thiết lập hệ phương trình liên quan đến số mol của các oxit sắt.
- Giải hệ phương trình: Giải hệ phương trình để tìm ra số mol của các oxit sắt trong hỗn hợp.
- Tính toán theo yêu cầu: Dựa vào số mol các chất, tính toán các giá trị cần tìm (ví dụ: phần trăm khối lượng, phần trăm số mol).
Bài Tập Vận Dụng
Bài 1: Khử hoàn toàn 23,2 gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 dư, sau phản ứng thu được m gam Fe và 7,2 gam nước. Tính giá trị của m.
Bài 2: Dẫn khí H2 dư qua ống đựng 16 gam hỗn hợp X gồm FeO và Fe2O3 nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y gồm Fe và H2O, trong đó khối lượng của Fe là 11,2 gam. Tính phần trăm khối lượng của FeO trong hỗn hợp X ban đầu.
Bài 3: Cho luồng khí H2 dư qua ống đựng m gam hỗn hợp X gồm CuO và Fe2O3 nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được 40 gam chất rắn và 9 gam nước. Tính giá trị của m.
Lưu Ý Khi Giải Bài Toán
- Đảm bảo phương trình phản ứng được cân bằng chính xác.
- Chú ý đến tỉ lệ mol giữa các chất trong phương trình phản ứng.
- Sử dụng định luật bảo toàn khối lượng để kiểm tra kết quả.
- Luyện tập giải nhiều bài tập để làm quen với các dạng toán khác nhau.
Việc nắm vững lý thuyết và phương pháp giải bài tập khử oxit sắt bằng H2 sẽ giúp bạn tự tin hơn trong các kỳ thi và kiểm tra. Chúc các bạn học tốt!