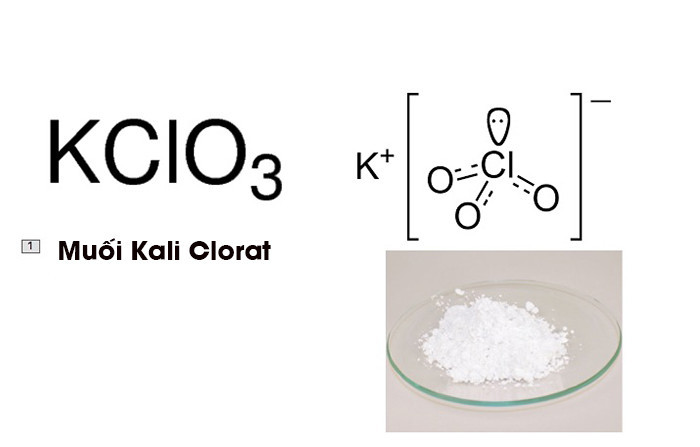
Kali clorat (KClO3) là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp và đời sống. Đặc biệt, phản ứng nhiệt phân KClO3 là một thí nghiệm hóa học cơ bản nhưng vô cùng quan trọng, được sử dụng để điều chế oxy trong phòng thí nghiệm và có nhiều ứng dụng khác. Bài viết này sẽ cung cấp thông tin chi tiết về Kclo3 Nhiệt Phân, bao gồm các phương trình phản ứng, ứng dụng thực tế và bài tập vận dụng.
1. Tổng Quan Về Kali Clorat (KClO3)
Kali clorat là một hợp chất tinh thể màu trắng, tan trong nước nóng và ít tan trong nước lạnh. Nó là một chất oxy hóa mạnh và có thể phản ứng với nhiều kim loại và phi kim.
Hình ảnh tinh thể Kali Clorat (KClO3), một chất oxy hóa mạnh được sử dụng rộng rãi.
Trong công nghiệp, KClO3 được sử dụng trong sản xuất pháo hoa, ngòi nổ, diêm và trong một số ứng dụng nông nghiệp.
2. Phản Ứng Nhiệt Phân KClO3
Phản ứng nhiệt phân KClO3 là quá trình phân hủy KClO3 dưới tác dụng của nhiệt độ. Có hai phương trình phản ứng nhiệt phân chính, phụ thuộc vào điều kiện nhiệt độ và sự có mặt của chất xúc tác.
2.1. Nhiệt Phân KClO3 Không Có Xúc Tác
Ở nhiệt độ cao (khoảng 400°C), KClO3 phân hủy thành kali perclorat (KClO4) và kali clorua (KCl):
4KClO3 → 3KClO4 + KCl
2.2. Nhiệt Phân KClO3 Có Xúc Tác MnO2
Khi có mặt chất xúc tác mangan đioxit (MnO2), phản ứng nhiệt phân KClO3 xảy ra ở nhiệt độ thấp hơn (khoảng 200°C) và tạo ra khí oxy (O2) và kali clorua (KCl):
2KClO3 → 2KCl + 3O2
Đây là phương pháp phổ biến để điều chế oxy trong phòng thí nghiệm vì nó đơn giản và hiệu quả.
Minh họa quá trình nhiệt phân KClO3 với xúc tác MnO2 để tạo ra khí oxy trong phòng thí nghiệm.
3. Ứng Dụng Của Phản Ứng Nhiệt Phân KClO3
- Điều chế oxy trong phòng thí nghiệm: Đây là ứng dụng quan trọng nhất của phản ứng nhiệt phân KClO3.
- Sản xuất pháo hoa và thuốc nổ: KClO3 là một thành phần quan trọng trong pháo hoa và thuốc nổ do khả năng oxy hóa mạnh của nó.
- Sản xuất diêm: KClO3 được sử dụng trong đầu que diêm để tạo ra phản ứng cháy nhanh chóng.
Hình ảnh minh họa ứng dụng của Kali Clorat trong sản xuất diêm, đóng vai trò là chất oxy hóa.
4. Bài Tập Vận Dụng Về KClO3 Nhiệt Phân
Để hiểu rõ hơn về phản ứng nhiệt phân KClO3, hãy cùng giải một số bài tập sau:
Bài 1: Nhiệt phân hoàn toàn 24.5 gam KClO3, thu được bao nhiêu lít khí O2 (ở điều kiện tiêu chuẩn)?
Lời giải:
- Số mol KClO3: n(KClO3) = 24.5 / 122.5 = 0.2 mol
- Phương trình phản ứng: 2KClO3 → 2KCl + 3O2
- Theo phương trình, số mol O2: n(O2) = (3/2) n(KClO3) = (3/2) 0.2 = 0.3 mol
- Thể tích O2 (đktc): V(O2) = 0.3 * 22.4 = 6.72 lít
Bài 2: Nhiệt phân KClO3 thu được 6.72 lít khí O2 (đktc). Tính khối lượng KClO3 đã dùng.
Lời giải:
- Số mol O2: n(O2) = 6.72 / 22.4 = 0.3 mol
- Phương trình phản ứng: 2KClO3 → 2KCl + 3O2
- Theo phương trình, số mol KClO3: n(KClO3) = (2/3) n(O2) = (2/3) 0.3 = 0.2 mol
- Khối lượng KClO3: m(KClO3) = 0.2 * 122.5 = 24.5 gam
Hình ảnh minh họa thí nghiệm nung KClO3 để tạo ra khí oxy, áp dụng trong giải các bài tập về nhiệt phân.
5. Lưu Ý Khi Sử Dụng KClO3
KClO3 là một chất oxy hóa mạnh và có thể gây cháy nổ nếu không được sử dụng đúng cách. Cần tuân thủ các biện pháp an toàn sau:
- Lưu trữ KClO3 ở nơi khô ráo, thoáng mát, tránh xa các chất dễ cháy.
- Không trộn KClO3 với các chất khử mạnh.
- Sử dụng KClO3 trong phòng thí nghiệm dưới sự giám sát của người có kinh nghiệm.
Hy vọng bài viết này đã cung cấp cho bạn đầy đủ thông tin về KClO3 nhiệt phân, từ các phương trình phản ứng đến ứng dụng thực tế và bài tập vận dụng. Việc nắm vững kiến thức về KClO3 nhiệt phân sẽ giúp bạn hiểu rõ hơn về hóa học và ứng dụng của nó trong đời sống.