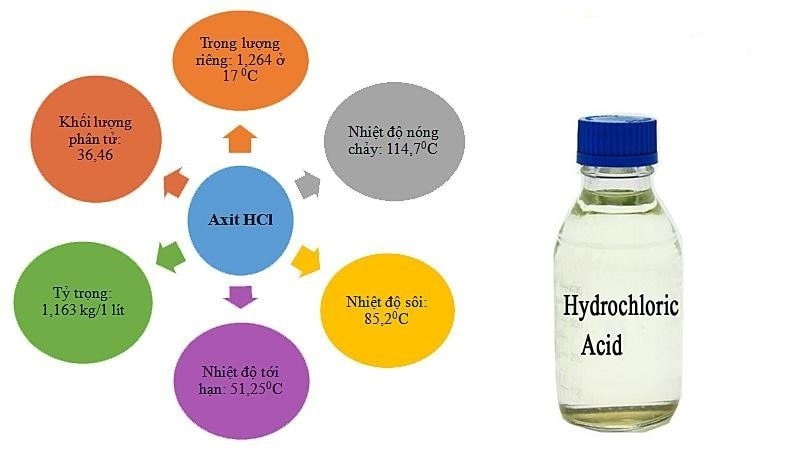
Axit clohydric (HCl) là một hóa chất quan trọng trong nhiều ngành công nghiệp và đời sống. Tuy nhiên, nhiều người vẫn thắc mắc về bản chất của nó, đặc biệt là liệu Hcl Là Oxit Axit Hay Oxit Bazơ. Bài viết này sẽ cung cấp câu trả lời chi tiết và dễ hiểu nhất.
Axit clohydric (HCl) là gì?
Axit clohydric (HCl) là một hợp chất vô cơ, có tính axit mạnh. Nó tồn tại ở hai dạng chính:
- Dạng khí: Khí hydro clorua (HCl) không màu, có mùi xốc.
- Dạng lỏng: Dung dịch axit clohydric được tạo ra bằng cách hòa tan khí hydro clorua trong nước.
HCl được sử dụng rộng rãi trong nhiều lĩnh vực, từ sản xuất công nghiệp đến y học, nhưng cần cẩn trọng khi sử dụng vì tính ăn mòn cao.
Phân loại oxit: Oxit axit và oxit bazơ
Để hiểu rõ hơn về bản chất của HCl, chúng ta cần phân biệt giữa oxit axit và oxit bazơ:
- Oxit axit: Là oxit của phi kim hoặc kim loại có hóa trị cao, tác dụng với nước tạo thành axit hoặc tác dụng với bazơ tạo thành muối và nước. Ví dụ: SO2, CO2, P2O5.
- Oxit bazơ: Là oxit của kim loại, tác dụng với nước tạo thành bazơ hoặc tác dụng với axit tạo thành muối và nước. Ví dụ: Na2O, CaO, MgO.
Vậy HCL là oxit axit hay oxit bazơ?
HCl không phải là oxit axit cũng không phải là oxit bazơ. HCl là một axit, được tạo thành từ hydro (H) và clo (Cl). Oxit là hợp chất của một nguyên tố với oxy (O). Vì HCl không chứa oxy trong công thức hóa học của nó, nên nó không thể được xếp vào loại oxit.
Tính chất hóa học của axit clohydric (HCl)
HCl thể hiện tính axit mạnh thông qua các phản ứng hóa học đặc trưng:
-
Làm đổi màu chất chỉ thị: Quỳ tím chuyển sang màu đỏ khi tiếp xúc với HCl.
-
Tác dụng với kim loại: HCl phản ứng với các kim loại đứng trước hydro (H) trong dãy hoạt động hóa học để tạo thành muối và giải phóng khí hydro (H2).
Ví dụ:
Fe + 2HCl → FeCl2 + H2↑
Phản ứng của HCl với kim loại sắt tạo ra muối và khí hydro
-
Tác dụng với oxit bazơ: HCl phản ứng với oxit bazơ tạo thành muối và nước.
Ví dụ:
CuO + 2HCl → CuCl2 + H2O
-
Tác dụng với bazơ: HCl phản ứng với bazơ tạo thành muối và nước (phản ứng trung hòa).
Ví dụ:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
-
Tác dụng với muối: HCl có thể tác dụng với một số muối để tạo thành muối mới và axit mới.
Ví dụ:
AgNO3 + HCl → AgCl + HNO3
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
-
Tính khử: HCl thể hiện tính khử khi tác dụng với các chất oxy hóa mạnh.
Ví dụ:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Ứng dụng của axit clohydric (HCl)
Axit clohydric có rất nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
-
Xử lý nước: Điều chỉnh độ pH, diệt khuẩn, khử trùng.
-
Tẩy gỉ sét: Loại bỏ gỉ sét trên bề mặt kim loại.
Ứng dụng của HCl trong tẩy gỉ sét kim loại
-
Sản xuất hóa chất: Nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.
-
Điều chỉnh pH: Kiểm soát và trung hòa độ pH trong nhiều quy trình công nghiệp.
-
Công nghiệp thực phẩm: Sản xuất phụ gia thực phẩm như aspartame, fructose.
Điều chế axit clohydric (HCl)
Trong phòng thí nghiệm, HCl có thể được điều chế bằng phản ứng giữa muối ăn (NaCl) và axit sulfuric đặc (H2SO4). Trong công nghiệp, HCl thường được sản xuất bằng cách đốt cháy hydro (H2) trong clo (Cl2).
Sơ đồ minh họa quy trình điều chế HCl trong phòng thí nghiệm
Tác hại của axit clohydric (HCl)
Mặc dù có nhiều ứng dụng quan trọng, HCl cũng có thể gây hại cho sức khỏe và môi trường nếu không được sử dụng đúng cách:
-
Ăn mòn: HCl có tính ăn mòn cao, có thể gây bỏng da và tổn thương nghiêm trọng cho mắt và hệ hô hấp.
-
Ô nhiễm môi trường: Khí HCl có thể gây ô nhiễm không khí và ảnh hưởng đến sự phát triển của cây cối.
Tác hại của HCl đối với cây cối
Kết luận
Tóm lại, axit clohydric (HCl) không phải là oxit axit hay oxit bazơ. Nó là một axit mạnh, có nhiều ứng dụng quan trọng trong công nghiệp và đời sống. Tuy nhiên, cần sử dụng cẩn thận để tránh gây hại cho sức khỏe và môi trường. Hiểu rõ về bản chất và tính chất của HCl là rất quan trọng để sử dụng nó một cách an toàn và hiệu quả.