Phản ứng giữa FeO (oxit sắt(II)) và HNO3 loãng là một phản ứng oxi hóa khử quan trọng trong hóa học vô cơ. Phản ứng này tạo ra sắt(III) nitrat, khí nitơ oxit và nước. Dưới đây là thông tin chi tiết về phản ứng này, bao gồm phương trình hóa học, điều kiện phản ứng, hiện tượng quan sát được và ứng dụng.
1. Phương trình phản ứng FeO tác dụng với HNO3 loãng:
Phương trình hóa học cân bằng của phản ứng như sau:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
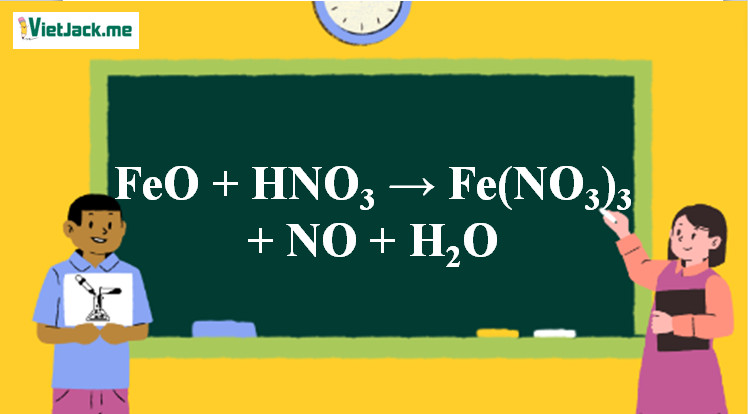 Phản ứng FeO tác dụng với axit HNO3 loãng tạo thành sắt(III) nitrat, khí NO và nước
Phản ứng FeO tác dụng với axit HNO3 loãng tạo thành sắt(III) nitrat, khí NO và nước
2. Cân bằng phương trình FeO + HNO3 → Fe(NO3)3 + NO + H2O:
Để cân bằng phương trình này, chúng ta sử dụng phương pháp thăng bằng electron:
- Quá trình oxi hóa: Fe+2 → Fe+3 + 1e
- Quá trình khử: N+5 + 3e → N+2
Từ đó, ta có phương trình phản ứng cân bằng:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
3. Điều kiện phản ứng giữa FeO và axit HNO3 loãng:
Phản ứng xảy ra ở điều kiện thường, không yêu cầu điều kiện đặc biệt nào về nhiệt độ hoặc áp suất.
4. Cách tiến hành phản ứng giữa FeO và axit HNO3 loãng:
Để thực hiện phản ứng, ta cho oxit sắt(II) (FeO) tác dụng với dung dịch axit nitric loãng (HNO3).
5. Hiện tượng phản ứng FeO và axit HNO3 loãng:
Hiện tượng quan sát được khi thực hiện phản ứng này là:
- Chất rắn màu đen của sắt(II) oxit (FeO) tan dần trong dung dịch.
- Xuất hiện khí nitơ oxit (NO) không màu, sau đó hóa nâu ngoài không khí do phản ứng với oxy trong không khí tạo thành NO2.
6. Bản chất của các chất tham gia phản ứng:
- FeO (Sắt(II) oxit): Trong phản ứng này, FeO đóng vai trò là chất khử, nhường electron cho HNO3. FeO dễ dàng bị oxi hóa thành Fe3+.
- HNO3 (Axit nitric): HNO3 đóng vai trò là chất oxi hóa, nhận electron từ FeO. HNO3 bị khử thành NO.
7. Tính chất hóa học của FeO:
FeO là một oxit bazơ, có tính khử đặc trưng.
- Tính chất của oxit bazơ: FeO tác dụng với axit tạo thành muối và nước.
- Ví dụ: FeO + 2HCl → FeCl2 + H2O
- Tính khử: FeO dễ bị oxi hóa thành hợp chất sắt(III).
- Ví dụ: 4FeO + O2 → 2Fe2O3
- Phản ứng với HNO3 loãng là một ví dụ điển hình cho tính khử của FeO.
8. Ứng dụng của FeO:
- FeO là một hợp chất quan trọng trong ngành luyện kim, được sử dụng để sản xuất gang và thép.
- FeO được sử dụng làm chất xúc tác trong một số phản ứng hóa học.
- Trong ngành gốm sứ, FeO được sử dụng để tạo màu cho sản phẩm.
9. Bài tập vận dụng liên quan đến FeO và HNO3 loãng:
Câu 1: Cho 11,2 gam Fe phản ứng hoàn toàn với dung dịch HNO3 loãng dư thu được V lít khí NO (đktc). Giá trị của V là bao nhiêu?
Câu 2: Hòa tan hoàn toàn m gam FeO trong dung dịch HNO3 loãng thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X thu được 32,67 gam muối khan. Giá trị của m là bao nhiêu?
Câu 3: Cho 2,88 gam hỗn hợp Fe và FeO phản ứng hoàn toàn với 200ml dung dịch HNO3 loãng thu được 0,448 lít khí NO (đktc) và dung dịch X. Tính nồng độ mol của HNO3 đã dùng.
10. Các phản ứng liên quan khác:
Ngoài phản ứng với HNO3 loãng, FeO còn tham gia nhiều phản ứng quan trọng khác như:
- FeO + HNO3 (đặc) → Fe(NO3)3 + NO2 + H2O
- FeO + H2SO4 (loãng) → FeSO4 + H2O
- FeO + H2SO4 (đặc, nóng) → Fe2(SO4)3 + SO2 + H2O
Hiểu rõ về phản ứng giữa FeO và HNO3 loãng, cùng với các tính chất và ứng dụng của FeO, giúp chúng ta nắm vững kiến thức hóa học vô cơ và ứng dụng chúng vào thực tế.
