Sắt (Fe) là một nguyên tố quan trọng trong hóa học và có vai trò thiết yếu trong nhiều lĩnh vực của đời sống. Một trong những đặc điểm thú vị của sắt là khả năng thể hiện nhiều hóa trị khác nhau trong các hợp chất. Vậy, Fe Hóa Trị mấy? Bài viết này sẽ đi sâu vào các hóa trị của sắt, lý do sắt có nhiều hóa trị, và các ví dụ minh họa cụ thể.
Fe Hóa Trị Mấy?
Sắt có hai hóa trị phổ biến nhất là hóa trị 2 (Fe²⁺) và hóa trị 3 (Fe³⁺). Tùy thuộc vào điều kiện phản ứng và các chất tham gia, sắt có thể thể hiện một trong hai hóa trị này.
Tại Sao Fe Có 2 Hóa Trị?
Để hiểu rõ hơn về điều này, chúng ta cần xem xét cấu hình electron của sắt. Sắt (Fe) có số hiệu nguyên tử là 26, và cấu hình electron của nó là: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s². Hoặc viết gọn là [Ar] 3d⁶ 4s².
Từ cấu hình electron này, ta thấy rằng sắt có 2 electron ở lớp ngoài cùng (4s²).
- Khi sắt mất đi 2 electron này, nó trở thành ion Fe²⁺, có hóa trị +2.
- Ngoài ra, sắt cũng có thể mất thêm một electron từ lớp 3d (mặc dù lớp 3d bền vững hơn khi có cấu hình d⁵ hoặc d¹⁰), tạo thành ion Fe³⁺, có hóa trị +3.
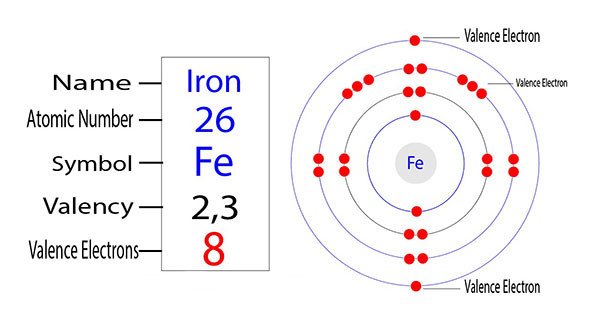 Cấu tạo electron của nguyên tử sắt quyết định các hóa trị của Fe
Cấu tạo electron của nguyên tử sắt quyết định các hóa trị của Fe
Khi Nào Fe Thể Hiện Hóa Trị II và III?
Việc sắt thể hiện hóa trị II hay III phụ thuộc vào các yếu tố sau:
Fe Hóa Trị II (Fe²⁺)
Sắt thường thể hiện hóa trị II khi tác dụng với:
- Axit loãng như HCl, H₂SO₄ loãng. Trong các phản ứng này, axit không có tính oxi hóa mạnh.
- Dung dịch muối của kim loại yếu hơn như muối đồng (Cu), muối chì (Pb).
- Phi kim có tính oxi hóa trung bình yếu như lưu huỳnh (S).
- Muối sắt (III) (Fe³⁺) trong điều kiện khử.
Ví dụ:
- Fe + H₂SO₄ (loãng) → FeSO₄ + H₂
- Fe + 2HCl → FeCl₂ + H₂
- Fe + Cu(NO₃)₂ → Fe(NO₃)₂ + Cu
- Fe + 2FeCl₃ → 3FeCl₂
- Fe + S → FeS
Fe Hóa Trị III (Fe³⁺)
Sắt thường thể hiện hóa trị III khi tác dụng với:
- Axit có tính oxi hóa mạnh như HNO₃, H₂SO₄ đặc nóng.
- Phi kim mạnh như flo (F₂), clo (Cl₂).
- Chất oxi hóa mạnh.
Ví dụ:
- 2Fe + 6H₂SO₄ (đặc, nóng) → Fe₂(SO₄)₃ + 6H₂O + 3SO₂
- 2Fe + 3Cl₂ → 2FeCl₃
- 2FeCl₂ + Cl₂ → 2FeCl₃
- 2FeO + O₂ → 2Fe₂O₃
Ứng Dụng Của Các Hợp Chất Sắt
Các hợp chất của sắt với các hóa trị khác nhau có nhiều ứng dụng quan trọng:
- Fe²⁺ (Sắt (II)): Thường được sử dụng trong các chất khử, phân bón, và trong sản xuất một số loại thuốc.
- Fe³⁺ (Sắt (III)): Được sử dụng rộng rãi trong xử lý nước thải (như phèn sắt), làm chất xúc tác, và trong sản xuất các sắc tố màu.
Kết Luận
Hiểu rõ về Fe hóa trị là một phần quan trọng trong việc nắm vững kiến thức hóa học về sắt. Sắt có thể thể hiện cả hóa trị II và III, tùy thuộc vào điều kiện phản ứng và các chất tham gia. Việc nắm vững các quy tắc và ví dụ cụ thể sẽ giúp bạn giải quyết các bài toán liên quan đến sắt một cách dễ dàng hơn.

