Sau khi phân tích 27 bộ gen mới từ các chủng FAdV phân lập ngoài đồng và các nguyên mẫu chưa được giải trình tự, chúng tôi báo cáo bằng chứng đầu tiên về sự tái tổ hợp ở FAdV. Tái tổ hợp giới hạn ở các loài FAdV-D và FAdV-E, chứa số lượng lớn nhất và các kiểu phân biệt nhất trong loài. Phần lớn các sự kiện được phát hiện xảy ra ở FAdV-E, liên quan đến các phân đoạn có nguồn gốc từ tất cả các kiểu cấu thành. Cùng với sự đa dạng của các điểm gãy, điều này cho thấy sự tái tổ hợp lan rộng ở loài này. Với những hạn chế có thể có thông qua các gen đặc trưng cho loài và các kiểu đa dạng hóa, tiềm năng tái tổ hợp của FAdV đạt được sự quan tâm đặc biệt đối với bệnh viêm gan thể vùi (IBH), một bệnh quan trọng ở gà do các kiểu từ loài dễ bị tái tổ hợp gây ra. Các phân đoạn tái tổ hợp, tiến hóa tự động, có liên quan đến các vị trí chính chịu sự chọn lọc dương tính, trong đó có protein vỏ capsid hexon và gen sợi, ORF 19 và 25 ở đầu cuối bên phải và họ ORF20/20A. Sự khảm quan sát được trong các gen được chỉ định là mục tiêu của áp lực thích nghi chỉ ra một chiến lược trốn tránh miễn dịch. Các chất tái tổ hợp hexon/sợi liên kiểu cho thấy các cấu hình trung hòa hỗn hợp, giải thích hồi cứu các tranh cãi được báo cáo về các chủng tham khảo B3-A, T8-A và X11-A. Hơn nữa, trung hòa chéo hỗ trợ bằng chứng dựa trên trình tự về sự tái tổ hợp giữa các miền trong sợi và đóng góp vào một kiểu mới dự kiến. Nhìn chung, những phát hiện của chúng tôi thách thức tính đồng nhất được cho là của các kiểu chịu trách nhiệm cho IBH, thúc giục các chiến lược nhận dạng đầy đủ hơn cho FAdV. Cuối cùng, những hậu quả quan trọng phát sinh đối với các nghiên cứu in vivo điều tra khả năng bảo vệ chéo chống lại IBH.
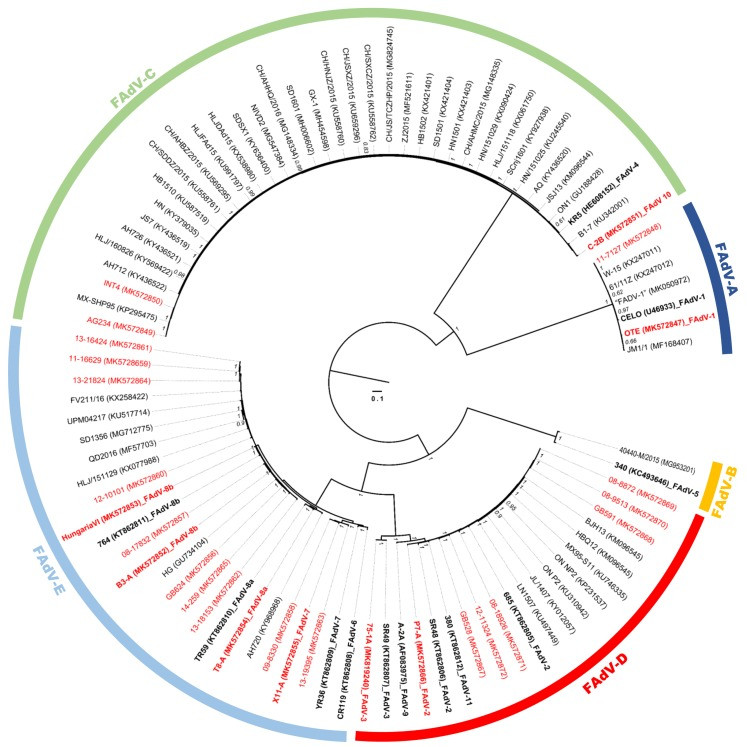
Fowl adenovirus (FAdV) thuộc chi Aviadenovirus (họ Adenoviridae), chủ yếu được phân lập từ gà, nhưng đôi khi cũng từ các vật chủ thuộc loài chim khác. Phân loại chính thức công nhận năm loài khác biệt về mặt bộ gen, từ Fowl aviadenovirus A đến Fowl aviadenovirus E (FAdV-A–FAdV-E), được chia thành các kiểu, được xác định bằng trung hòa chéo (FAdV-1 đến -8a, -8b đến -11) và kiểu gen dựa trên các tiêu chí phân tử.
Sự ra đời của phương pháp định kiểu phân tử FAdV chủ yếu được chứng thực bởi các phương pháp phát hiện sử dụng protein cấu trúc chính hexon, có thể được hài hòa rộng rãi với kết quả từ phương pháp huyết thanh truyền thống. Là một công cụ nhanh chóng để suy luận kiểu, điều này đã cách mạng hóa việc định kiểu FAdV đến mức hexon trở thành mục tiêu phổ biến để xác định đặc điểm chủng trong hai thập kỷ qua.
Mặc dù sự phong phú của dữ liệu hexon đã đóng góp quan trọng vào việc nhận ra các kiểu cụ thể cho các hình ảnh lâm sàng riêng biệt, các so sánh liên bộ gen có hệ thống của FAdV bên ngoài phương pháp này đang tụt hậu xa so với trạng thái hiện đại trong adenovirus ở động vật có vú, đặc biệt là adenovirus ở người (HAdV) thuộc chi Mastadenovirus.
Hiện tại, mười một bộ gen nguyên mẫu FAdV đã được giải trình tự hoàn toàn (chỉ có một bộ gen một phần có sẵn cho FAdV-10, thành viên kiểu của loài FAdV-C). Về sự đa dạng hóa, FAdV-D và FAdV-E, có liên quan chặt chẽ về mặt phát sinh loài và sinh học (là tác nhân gây bệnh của cùng một bệnh, viêm gan thể vùi, tức là IBH), đại diện cho các loài đặc biệt, chứa phần lớn các kiểu huyết thanh và kiểu gen FAdV duy nhất. Tuy nhiên, bản thiết kế hiện có cho sự đa dạng kiểu trong FAdV-D và FAdV-E chủ yếu dựa trên một bộ gen tham khảo duy nhất cho mỗi kiểu cấu thành, được đại diện bởi các chủng tham khảo không gây bệnh đã bị làm suy yếu do nuôi cấy in vitro lâu dài kể từ khi chúng được phân lập và mô tả ban đầu vào giữa thế kỷ trước. Đối với bộ gen của các chủng phân lập ngoài đồng đương đại, cho đến nay chỉ có những đóng góp đơn lẻ cho các cơ sở dữ liệu công cộng. Gần đây, tình hình này đã thay đổi đối với FAdV-4 (FAdV-C), với sự xuất hiện đột ngột của hội chứng viêm gan-tràn dịch màng tim (HHS) ở Trung Quốc, dẫn đến nguồn cung cấp rộng rãi các trình tự liên quan.
Dựa trên bộ gen tham khảo đã biết cho tất cả các loài và hầu hết tất cả các kiểu, người ta đã quan sát thấy rằng sự đa dạng trong FAdV được quyết định bởi sự biến đổi khuôn mẫu trong các bản sao bộ gen trung tâm đặc biệt. Bên cạnh đó, có những khác biệt ít được mô tả rõ ràng hơn về độ tương đồng nucleotide và hàm lượng ORF của các vùng đầu cuối, bao gồm một phần đáng kể (khoảng hai phần ba) tổng bộ gen FAdV. Hàm lượng của đầu cuối FAdV, đặc biệt là liên quan đến phiên mã, biểu hiện và chức năng của chúng, vẫn chưa được hiểu rõ. Tuy nhiên, với nhận thức ngày càng tăng rằng không thể chỉ sử dụng các yếu tố quyết định kháng nguyên để phân biệt đáng tin cậy các kiểu hình nhất định, ví dụ như sự khác biệt về khả năng gây bệnh giữa các chủng cùng một kiểu huyết thanh, ngày càng có nhiều sự quan tâm đến việc làm sáng tỏ sự biến đổi đầu cuối trong FAdV và mối liên hệ của nó với tính đặc hiệu của kiểu và độc lực.
Gần đây, chúng tôi đã xác định các chủng có tính đặc hiệu của kiểu mâu thuẫn trong các yếu tố quyết định biến đổi nhất, vòng lặp-1 hexon và sợi, không tương thích với sơ đồ kiểu gen hiện có. Phát hiện này, lần đầu tiên, đã phơi bày những thiếu sót của các phương pháp định kiểu FAdV chỉ dựa vào một vùng bộ gen duy nhất.
Từ quan điểm lâm sàng, điều này xem xét kỹ lưỡng (i) mô hình các bệnh cụ thể liên quan đến một tập hợp hạn chế các kiểu, với các kiểu được xác định chỉ bằng hexon, và (ii) khả năng bảo vệ chéo giữa các FAdV ít được mô tả rõ ràng hơn trong các mô hình thử nghiệm vắc-xin.
Dựa trên dữ liệu bộ gen когорт FAdV mở rộng, chúng tôi đã có thể xác định một loạt các chuyển đổi тополошки trong cây phát sinh loài của các vùng bộ gen thông tin, cung cấp, lần đầu tiên, bằng chứng về sự tái tổ hợp và sự xuất hiện có hệ thống của nó trong FAdV. Việc tìm thấy sự tái tổ hợp có thể được mở rộng đối với các chủng tham khảo chưa được giải trình tự cho đến nay và một chủng phân lập ngoài đồng mới được tuyển dụng với sự trao đổi giữa các miền trong sợi của nó. Những kết quả này ngụ ý rằng FAdV tuần hoàn, chủ yếu từ các loài FAdV-D và FAdV-E, đa dạng về mặt di truyền hơn so với kết luận trước đây từ dữ liệu có sẵn. Ngoài ra, chúng tôi đã điều tra những hậu quả của việc xáo trộn kháng nguyên trong các chất tái tổ hợp bằng trung hòa chéo truyền thống, xem xét lần đầu tiên tất cả các chủng tham khảo đã biết của các loài FAdV được kiểm tra cùng nhau trong một cài đặt.
Các phân tích phát sinh loài phân tử và kiểu hình chọn lọc dương tính của FAdV cho thấy sự khác biệt đáng kể về cảnh quan đột biến của các loài khác nhau. FAdV-E có tỷ lệ chọn lọc dương tính trên toàn bộ генома cao nhất (6,7%), so với 3,8% ở FAdV-D. Các cửa sổ cho thấy mật độ vị trí cao của các codon chịu sự chọn lọc dương tính chủ yếu tương ứng với các vùng đầu cuối (ORF14a ở đầu генома bên trái và ORF 20A, 19, 28, 16 và 19A ở đầu генома bên trái), khu vực của vòng lặp hexon-1 và -2, гена 33K và cả hai гена sợi. Phân tích này nhấn mạnh sự khác biệt trong áp lực tiến hóa tác động lên các loài FAdV khác nhau.
Phân tích thành phần генома và kháng nguyên của các chủng FAdV-D và FAdV-E cho thấy sự khác biệt đáng kể về sự đa dạng di truyền và kiểu kháng nguyên. Mặc dù có sự bảo tồn toàn cầu cao giữa các thành viên chủng của cả hai loài (≥90,0% đồng nhất nt), sự phân kỳ lên đến 27% xảy ra ở bốn phân đoạn генома được xác định với hàm lượng phát sinh loài không lặp đi lặp lại, được xác định trên cơ sở loài phân kỳ nhất, FAdV-E. Hai trong số các phân đoạn này tập trung vào các miền kháng nguyên, một bao gồm hexon và một bao gồm sợi và các ORF 22, 20A liền kề của nó, cũng như đầu 3′ của ORF20. Hai phân đoạn khác nằm ở đầu cuối bên phải, một kéo dài ORF19 và đầu 5′ của ORF20, và một cái khác là một chuỗi các ORF 11, 23 và 25.
Phân tích chi tiết các miền kháng nguyên chính cho thấy rằng (i) đa hình trong hexon ánh xạ gần như hoàn toàn đến các vị trí tương đối của vòng lặp-1, -2 và -4, như được xác định bởi Sheppard và cộng sự, (ii) sợi hoàn toàn siêu biến đổi và (iii) penton base có mức độ biến đổi tương đối thấp.
So với các генома tham khảo đã được công bố, ít nhất bốn chủng phân lập ngoài đồng FAdV-E, cũng như ba trong số bốn chủng nguyên mẫu FAdV-E mới thu được có thành phần duy nhất, thể hiện rõ từ các mối quan hệ phát sinh loài không phù hợp giữa các vùng генома thông tin và các giao điểm trong cấu hình SimPlot của chúng.
Phân tích đồng tiến hóa và tái tổ hợp của FAdV-D và FAdV-E cho thấy bằng chứng về sự tái tổ hợp trong cả hai loài. Mặc dù các điểm gãy được phân bố trên toàn bộ генома, sự tái tổ hợp tập trung vào các vị trí điểm nóng chính, được xác định bởi ranh giới với CI 99% cho các ước tính điểm gãy cục bộ dự kiến sẽ xảy ra ngẫu nhiên. Trong FAdV-D, một tín hiệu sắc nét, nổi bật tập trung vào vị trí 20.009, ánh xạ trực tiếp ngược dòng của гена hexon. Hơn nữa, toàn bộ khu vực xung quanh, bao gồm гена pVI và đầu 5′ của hexon, chứa một điểm nóng tái tổ hợp. Các đỉnh bổ sung nằm trong khu vực генома của các ORF 12 và 13 ở đầu bên trái và ở đầu 3′ của penton base.
Tương tự như vậy, trong FAdV-E, hexon tạo thành một điểm nóng chính để tái tổ hợp, kéo dài đến các vùng và гена gian гена liền kề. Sự tích lũy điểm gãy bổ sung trên CI 95% xảy ra trong FAdV-E ở cả hai phía của гена sợi. Một điểm nóng giả định khác bao gồm GAM-1 và vùng gian гена trước đó có chứa một sự lặp lại 33 bp của số lượng bản sao khác nhau (lặp lại тандем-1). Các họa tiết trình tự lặp đi lặp lại định kỳ cũng được quan sát thấy gần các điểm nóng được dự đoán trong DNA polymerase, vùng mã hóa chồng chéo cho 100K, 22K và 33K, cũng như các lặp lại đầu cuối đảo ngược (ITR), cho thấy một mối liên hệ có thể có giữa các yếu tố генома lặp đi lặp lại và tái tổ hợp.
Các xét nghiệm trung hòa chéo đã được thực hiện để xác nhận kết quả giải trình tự và xác định mối quan hệ huyết thanh giữa các chủng FAdV khác nhau. Trong FAdV-E, không có mối quan hệ huyết thanh nào được quan sát thấy giữa các đại diện nguyên mẫu CR119 (FAdV-6), YR36 (FAdV-7), TR59 (FAdV-8a) và 764 (FAdV-8b), xác nhận danh tính huyết thanh riêng biệt của chúng (sau đây gọi là các chủng kiểu “chính hãng”). Ngược lại, các phản ứng chéo của hai trong số các đại diện kiểu chính hãng này, T8-A (phản ứng với FAdV-8a và -8b) và B3-A (phản ứng với FAdV-7 và -8b) đã xảy ra, dựa trên trung hòa hai chiều trong mỗi trường hợp. Mặc dù kháng huyết thanh chống lại chủng HungariaVI tạo ra hoạt động trung hòa chống lại tất cả các vi rút được thử nghiệm với гена hexon và/hoặc sợi đặc hiệu 8b, HungariaVI lần lượt chỉ được nhận ra bởi kháng huyết thanh chống lại chủng 764. Bên cạnh đó, một số phản ứng chéo cũng được ghi nhận chống lại chủng FAdV-8a chính hãng TR59, nhưng титър thấp hơn ngưỡng tỷ lệ đồng đẳng:dị đẳng 8 lần.
Các chủng FAdV-E tái tổ hợp được giải quyết trong nghiên cứu này được phân lập từ các đợt bùng phát IBH hoặc gây ra bệnh trong các cài đặt thực nghiệm, làm nổi bật sự liên quan lâm sàng của chúng. Các phân đoạn kháng nguyên có nguồn gốc từ các kiểu -6 và -7, thường không liên quan đến IBH, cũng được tìm thấy trong số các chủng phân lập ngoài đồng (12-10101, 09-8330 và 13-19395), mặc dù dữ liệu thực nghiệm về khả năng gây bệnh của hai chủng sau vẫn chưa có sẵn cho đến nay. Tuy nhiên, điều này phơi bày một khoảng cách có thể có trong việc nhận dạng “các kiểu” và mối liên hệ của chúng với bệnh.
Tóm lại, nghiên cứu này cung cấp bằng chứng đầu tiên về sự tái tổ hợp trong FAdV, đặc biệt là trong các loài FAdV-D và FAdV-E. Sự tái tổ hợp này có thể có tác động đáng kể đến sự tiến hóa của vi rút, kiểu kháng nguyên và khả năng bảo vệ chéo. Những phát hiện này nhấn mạnh sự cần thiết của các chiến lược nhận dạng đầy đủ hơn cho FAdV và những hậu quả quan trọng đối với các nghiên cứu in vivo điều tra khả năng bảo vệ chéo chống lại IBH.