Trạng thái cơ bản của nguyên tử Hiđrô
Trạng thái cơ bản của nguyên tử Hiđrô là trạng thái mà electron của nó chiếm mức năng lượng thấp nhất. Đây là một khái niệm then chốt trong việc hiểu cấu trúc và tính chất của nguyên tử đơn giản nhất này, làm nền tảng cho việc nghiên cứu các nguyên tử phức tạp hơn.
Mẫu nguyên tử Bohr và trạng thái cơ bản
Mẫu nguyên tử Bohr, mặc dù có những hạn chế nhất định, đã đưa ra một hình ảnh trực quan về trạng thái cơ bản. Theo Bohr, electron trong nguyên tử Hiđrô chỉ có thể tồn tại ở những quỹ đạo nhất định, tương ứng với các mức năng lượng cụ thể. Trạng thái cơ bản ứng với quỹ đạo gần hạt nhân nhất, còn được gọi là quỹ đạo K.
Ảnh này minh họa các quỹ đạo dừng trong mẫu nguyên tử Bohr, giúp hình dung vị trí của electron trong trạng thái cơ bản và các trạng thái kích thích.
Năng lượng và bán kính quỹ đạo Bohr
Trong trạng thái cơ bản, electron có năng lượng thấp nhất và bán kính quỹ đạo của nó là nhỏ nhất. Bán kính này được gọi là bán kính Bohr, thường được ký hiệu là $r_0$ và có giá trị khoảng 0.53 Å (angstrom). Năng lượng tương ứng với trạng thái cơ bản của nguyên tử Hiđrô là -13.6 eV (electron volt).
Tiên đề Bohr và sự chuyển trạng thái
Tiên đề Bohr về sự bức xạ và hấp thụ năng lượng giải thích rằng khi electron chuyển từ một trạng thái năng lượng cao hơn (trạng thái kích thích) về trạng thái cơ bản, nó sẽ phát ra một photon có năng lượng bằng hiệu năng lượng giữa hai trạng thái.
Ảnh này thể hiện electron chuyển từ mức năng lượng cao xuống mức năng lượng thấp, kèm theo sự phát xạ photon.
Ứng dụng và ý nghĩa
Việc hiểu rõ về Electron Trong Trạng Thái Cơ Bản Của Nguyên Tử Hiđrô có nhiều ứng dụng quan trọng trong các lĩnh vực như:
- Quang phổ học: Nghiên cứu quang phổ phát xạ và hấp thụ của Hiđrô giúp xác định các mức năng lượng và cấu trúc nguyên tử.
- Hóa học lượng tử: Làm cơ sở để tính toán và mô phỏng các hệ thống phức tạp hơn.
- Vật lý plasma: Hiểu các quá trình xảy ra trong plasma chứa Hiđrô.
Bài tập vận dụng
Bài 1: Tính năng lượng của photon phát ra khi electron trong nguyên tử Hiđrô chuyển từ quỹ đạo n=2 về trạng thái cơ bản (n=1).
Giải:
Sử dụng công thức: $E = E_2 – E_1 = -13.6 eV (1/2^2 – 1/1^2) = 10.2 eV$
Bài 2: Bán kính quỹ đạo Bohr thứ nhất của nguyên tử Hiđrô là $r_0$. Tính bán kính quỹ đạo khi electron ở trạng thái n=3.
Giải:
Sử dụng công thức: $r_n = n^2 r_0 = 3^2 r_0 = 9r_0$
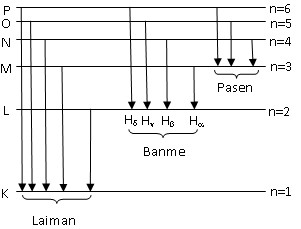
Ảnh này cho thấy mối tương quan giữa số lượng tử chính (n) và tên gọi của các quỹ đạo dừng, giúp xác định quỹ đạo tương ứng với trạng thái cơ bản.
Hiểu rõ về trạng thái cơ bản của electron trong nguyên tử Hiđrô là nền tảng quan trọng để tiếp cận các khái niệm phức tạp hơn trong vật lý nguyên tử và hóa học lượng tử.