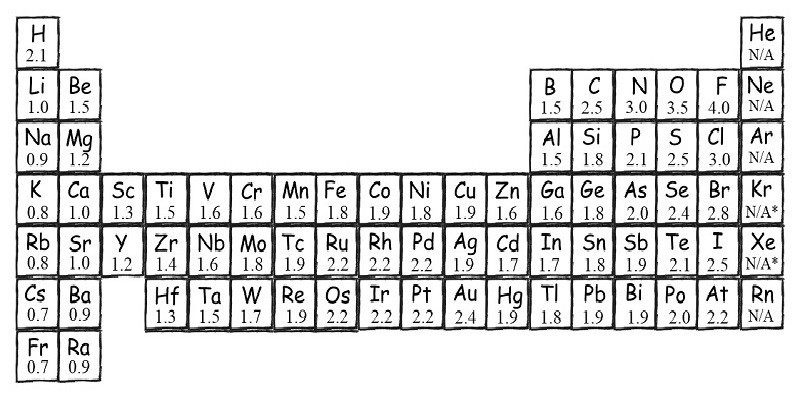
Độ âm điện là một khái niệm then chốt trong hóa học, giúp ta hiểu rõ hơn về tính chất của các nguyên tố và khả năng liên kết của chúng. Vậy độ âm điện là gì và nó biến đổi như thế nào trong bảng tuần hoàn? Hãy cùng khám phá sâu hơn về chủ đề này.
Độ Âm Điện Là Gì?
Độ âm điện là thước đo khả năng của một nguyên tử trong phân tử hút electron về phía mình. Nguyên tử có độ âm điện càng cao thì lực hút electron càng mạnh. Độ âm điện không phải là một đại lượng có thể đo trực tiếp mà được tính toán dựa trên các tính chất khác của nguyên tử.
Độ âm điện đóng vai trò quan trọng trong việc xác định kiểu liên kết hóa học giữa các nguyên tử. Sự khác biệt về độ âm điện giữa hai nguyên tử sẽ quyết định liên kết đó là liên kết cộng hóa trị (phân cực hay không phân cực) hay liên kết ion.
Nói tóm lại:
- Nguyên tố có độ âm điện nhỏ thể hiện tính kim loại mạnh.
- Nguyên tố có độ âm điện lớn thể hiện tính phi kim mạnh.
- Thang Pauling là thang đo độ âm điện phổ biến nhất.
- Fluorine (F) có độ âm điện lớn nhất (3.98) và được dùng làm chuẩn để so sánh.
Xu Hướng Biến Đổi Độ Âm Điện Trong Bảng Tuần Hoàn
Độ âm điện không phải là một hằng số mà thay đổi theo vị trí của nguyên tố trong bảng tuần hoàn. Có những quy luật nhất định chi phối sự biến đổi này.
Trong một chu kỳ
Khi di chuyển từ trái sang phải trong một chu kỳ, độ âm điện của các nguyên tố thường tăng lên. Điều này là do điện tích hạt nhân tăng lên, kéo electron gần hạt nhân hơn và làm tăng khả năng hút electron.
Trong một nhóm
Khi di chuyển từ trên xuống dưới trong một nhóm, độ âm điện của các nguyên tố thường giảm xuống. Điều này là do số lớp electron tăng lên, làm tăng khoảng cách giữa electron hóa trị và hạt nhân, làm giảm lực hút.
Sự biến đổi tuần hoàn của độ âm điện trong bảng tuần hoàn: Độ âm điện tăng dần từ trái sang phải trong một chu kỳ và giảm dần từ trên xuống dưới trong một nhóm.
Các Yếu Tố Ảnh Hưởng Đến Độ Âm Điện
Ngoài vị trí trong bảng tuần hoàn, độ âm điện còn chịu ảnh hưởng bởi một số yếu tố khác.
Kích thước nguyên tử
Nguyên tử càng lớn, các electron ở lớp ngoài cùng càng cách xa hạt nhân, lực hút giảm và độ âm điện giảm.
Điện tích hạt nhân
Điện tích hạt nhân càng lớn, lực hút electron càng mạnh và độ âm điện tăng.
Nhóm thế
Các nhóm thế gắn vào một nguyên tử cũng có thể ảnh hưởng đến độ âm điện của nó. Nhóm thế hút electron sẽ làm tăng độ âm điện của nguyên tử trung tâm, và ngược lại.
Liên Kết Hóa Học và Hiệu Độ Âm Điện
Hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là cơ sở để dự đoán loại liên kết hình thành.
Liên kết cộng hóa trị không cực
Nếu hiệu độ âm điện giữa hai nguyên tử rất nhỏ (thường dưới 0.4), các electron sẽ được chia sẻ gần như đồng đều và tạo thành liên kết cộng hóa trị không cực. Ví dụ: liên kết trong phân tử H₂ hoặc Cl₂.
Liên kết cộng hóa trị có cực
Nếu hiệu độ âm điện nằm trong khoảng từ 0.4 đến 1.7, các electron sẽ bị hút lệch về phía nguyên tử có độ âm điện cao hơn, tạo thành liên kết cộng hóa trị có cực. Ví dụ: liên kết trong phân tử H₂O.
Liên kết ion
Nếu hiệu độ âm điện lớn hơn hoặc bằng 1.7, nguyên tử có độ âm điện cao hơn sẽ hút electron hoàn toàn từ nguyên tử kia, tạo thành các ion trái dấu hút nhau bằng lực tĩnh điện, hình thành liên kết ion. Ví dụ: liên kết trong hợp chất NaCl.
Các yếu tố ảnh hưởng đến độ âm điện của một nguyên tố: Kích thước nguyên tử, điện tích hạt nhân và ảnh hưởng của các nhóm thế.
Hiểu rõ về độ âm điện và các yếu tố ảnh hưởng đến nó giúp chúng ta dự đoán và giải thích được nhiều tính chất hóa học của các nguyên tố và hợp chất. Đây là một kiến thức nền tảng quan trọng trong hóa học mà bất kỳ ai quan tâm đến lĩnh vực này cũng cần nắm vững.