Ăn mòn điện hóa là một quá trình phá hủy kim loại quan trọng, gây ra nhiều thiệt hại về kinh tế và ảnh hưởng đến độ bền của các công trình, thiết bị. Vậy, điều Kiện để Xảy Ra ăn Mòn điện Hóa là gì? Bài viết này sẽ đi sâu vào phân tích các yếu tố cần thiết để quá trình này diễn ra, đồng thời cung cấp các ví dụ minh họa và giải pháp phòng ngừa hiệu quả.
Để xảy ra ăn mòn điện hóa, cần hội tụ đủ ba yếu tố chính:
- Các điện cực khác nhau về bản chất:
- Đây là yếu tố tiên quyết. Các điện cực có thể là hai kim loại khác nhau (ví dụ: sắt và đồng), kim loại và phi kim (ví dụ: kẽm và than chì), hoặc kim loại và hợp chất (ví dụ: thép và oxit sắt).
- Sự khác biệt về bản chất tạo ra sự chênh lệch về điện thế giữa các điện cực, từ đó hình thành dòng điện. Kim loại có thế điện cực chuẩn nhỏ hơn sẽ đóng vai trò là cực âm (anode), nơi xảy ra quá trình oxy hóa và kim loại bị ăn mòn.
- Sự tiếp xúc điện:
- Các điện cực phải tiếp xúc trực tiếp với nhau (ví dụ: hai kim loại được hàn hoặc ghép nối trực tiếp) hoặc gián tiếp thông qua dây dẫn.
- Sự tiếp xúc này cho phép dòng điện hình thành do chênh lệch điện thế giữa các điện cực có thể lưu thông, thúc đẩy quá trình ăn mòn.
- Môi trường điện ly:
- Các điện cực phải cùng tiếp xúc với môi trường điện ly, thường là dung dịch chất điện ly như nước biển, axit, kiềm, hoặc thậm chí chỉ là hơi ẩm trong không khí.
- Môi trường điện ly đóng vai trò là cầu nối để các ion di chuyển giữa các điện cực, hoàn thành mạch điện và cho phép quá trình ăn mòn diễn ra liên tục.
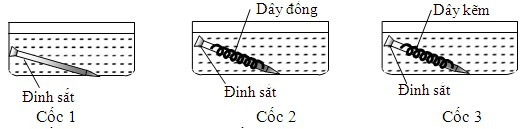 Đinh sắt bị ăn mòn trong cốc nước muối do tạo thành pin điện hóa, oxy hóa sắt thành ion Fe2+
Đinh sắt bị ăn mòn trong cốc nước muối do tạo thành pin điện hóa, oxy hóa sắt thành ion Fe2+
Ví dụ: Trong thí nghiệm với đinh sắt trong các môi trường khác nhau, đinh sắt trong cốc nước muối sẽ bị ăn mòn nhanh nhất. Điều này là do nước muối là một chất điện ly mạnh, tạo điều kiện thuận lợi cho sự hình thành pin điện hóa giữa các vùng khác nhau trên bề mặt đinh sắt, dẫn đến quá trình ăn mòn xảy ra nhanh chóng.
Cơ Chế Ăn Mòn Điện Hóa
Khi các điều kiện trên được đáp ứng, quá trình ăn mòn điện hóa diễn ra theo các bước sau:
- Hình thành pin điện hóa: Hai điện cực khác nhau về bản chất nhúng trong môi trường điện ly tạo thành một pin điện hóa. Điện cực có thế điện cực chuẩn nhỏ hơn sẽ là cực âm (anode), và điện cực có thế điện cực chuẩn lớn hơn sẽ là cực dương (cathode).
- Oxy hóa ở cực âm: Tại cực âm, kim loại bị oxy hóa, nhường electron và tan vào dung dịch dưới dạng ion kim loại. Ví dụ, đối với sắt (Fe):
Fe -> Fe2+ + 2e- - Khử ở cực dương: Tại cực dương, các electron được giải phóng từ cực âm sẽ tham gia vào quá trình khử các chất có trong môi trường điện ly. Ví dụ, trong môi trường axit, ion hydro (H+) sẽ bị khử:
2H+ + 2e- -> H2
Trong môi trường trung tính hoặc kiềm, oxy hòa tan (O2) sẽ bị khử:
O2 + 2H2O + 4e- -> 4OH- - Di chuyển ion: Các ion kim loại (ví dụ: Fe2+) di chuyển từ cực âm vào dung dịch, trong khi các ion khác (ví dụ: OH-) di chuyển về phía cực âm để duy trì sự trung hòa điện.
- Hình thành sản phẩm ăn mòn: Các ion kim loại phản ứng với các chất khác trong dung dịch để tạo thành các sản phẩm ăn mòn, chẳng hạn như oxit, hydroxit, hoặc muối.
Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Ăn Mòn Điện Hóa
Tốc độ ăn mòn điện hóa phụ thuộc vào nhiều yếu tố, bao gồm:
- Bản chất của kim loại: Kim loại có thế điện cực chuẩn càng âm thì càng dễ bị ăn mòn.
- Sự chênh lệch điện thế giữa các điện cực: Sự chênh lệch điện thế càng lớn thì tốc độ ăn mòn càng cao.
- Nồng độ chất điện ly: Nồng độ chất điện ly càng cao thì tốc độ ăn mòn càng nhanh.
- Nhiệt độ: Nhiệt độ tăng thường làm tăng tốc độ ăn mòn.
- Sự có mặt của oxy hòa tan: Oxy hòa tan đóng vai trò quan trọng trong quá trình khử ở cực dương, do đó sự có mặt của oxy hòa tan thường làm tăng tốc độ ăn mòn.
- pH của môi trường: pH của môi trường có thể ảnh hưởng đến tốc độ ăn mòn, tùy thuộc vào loại kim loại và chất điện ly.
Các Biện Pháp Phòng Ngừa Ăn Mòn Điện Hóa
Có nhiều biện pháp để phòng ngừa ăn mòn điện hóa, bao gồm:
- Chọn vật liệu phù hợp: Chọn các vật liệu có tính chống ăn mòn cao hoặc sử dụng các vật liệu tương thích về điện hóa khi tiếp xúc với nhau.
- Sử dụng lớp phủ bảo vệ: Áp dụng các lớp phủ bảo vệ như sơn, mạ, hoặc lớp phủ oxit để ngăn chặn sự tiếp xúc giữa kim loại và môi trường ăn mòn.
- Sử dụng chất ức chế ăn mòn: Thêm các chất ức chế ăn mòn vào môi trường điện ly để làm chậm quá trình ăn mòn.
- Bảo vệ catot: Sử dụng một kim loại hoạt động hơn (ví dụ: kẽm) để làm cực âm, bảo vệ kim loại cần bảo vệ (ví dụ: sắt) khỏi bị ăn mòn. Đây là nguyên tắc của phương pháp mạ kẽm hoặc sử dụng anode hy sinh.
Ví dụ: Sắt tây (sắt tráng thiếc) khi bị xước lớp tráng, sắt sẽ bị ăn mòn trước do có tính khử mạnh hơn thiếc. Đây là một ví dụ về bảo vệ điện hóa, trong đó kim loại hoạt động hơn (sắt) hy sinh để bảo vệ kim loại ít hoạt động hơn (thiếc).
Hiểu rõ các điều kiện để xảy ra ăn mòn điện hóa và các yếu tố ảnh hưởng đến quá trình này là rất quan trọng để lựa chọn vật liệu, thiết kế công trình và áp dụng các biện pháp phòng ngừa ăn mòn hiệu quả, từ đó kéo dài tuổi thọ của các thiết bị và công trình, giảm thiểu thiệt hại về kinh tế.

