Điện phân dung dịch NaOH là một quá trình quan trọng trong hóa học và công nghiệp, được ứng dụng rộng rãi để điều chế các chất và thực hiện các phản ứng hóa học. Bài viết này sẽ đi sâu vào cơ chế điện Phân Dung Dịch Naoh, các yếu tố ảnh hưởng và một số bài tập minh họa.
Cơ Chế Điện Phân Dung Dịch NaOH
Điện phân là quá trình sử dụng dòng điện một chiều để kích hoạt các phản ứng oxy hóa khử không tự xảy ra. Khi điện phân dung dịch NaOH (natri hydroxit) với điện cực trơ, các ion Na+ và OH- trong dung dịch sẽ di chuyển về các điện cực. Tuy nhiên, do thế điện cực của nước thấp hơn Na+, nước sẽ bị điện phân thay vì ion Na+.
Tại catot (điện cực âm), xảy ra quá trình khử nước:
2H₂O + 2e⁻ → H₂↑ + 2OH⁻
Khí hydro (H₂) được giải phóng và ion hydroxit (OH⁻) được tạo ra, làm tăng nồng độ OH⁻ gần catot, khiến pH tăng.
Tại anot (điện cực dương), xảy ra quá trình oxy hóa nước:
2H₂O → O₂↑ + 4H⁺ + 4e⁻
Khí oxy (O₂) được giải phóng và ion hydro (H⁺) được tạo ra. Các ion H⁺ này nhanh chóng phản ứng với OH⁻ trong dung dịch, cân bằng pH.
Tổng quát, phương trình điện phân dung dịch NaOH thực chất là điện phân nước:
2H₂O → 2H₂↑ + O₂↑
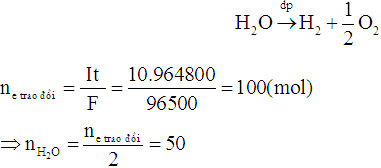 Sơ đồ điện phân dung dịch NaOH minh họa quá trình điện phân nước thành khí hidro và oxi.
Sơ đồ điện phân dung dịch NaOH minh họa quá trình điện phân nước thành khí hidro và oxi.
Quá trình điện phân dung dịch NaOH thực chất là điện phân nước, tạo ra khí hidro ở catot và khí oxi ở anot. Dung dịch NaOH đóng vai trò chất điện ly, giúp tăng độ dẫn điện của dung dịch.
Các Yếu Tố Ảnh Hưởng Đến Điện Phân Dung Dịch NaOH
Một số yếu tố ảnh hưởng đến quá trình điện phân dung dịch NaOH:
- Nồng độ NaOH: Nồng độ NaOH càng cao, độ dẫn điện của dung dịch càng tốt, quá trình điện phân diễn ra hiệu quả hơn.
- Cường độ dòng điện: Cường độ dòng điện càng lớn, lượng khí H₂ và O₂ tạo ra trong một đơn vị thời gian càng nhiều.
- Điện cực: Sử dụng điện cực trơ (như Pt, graphite) để tránh điện cực tham gia vào phản ứng.
- Nhiệt độ: Nhiệt độ tăng thường làm tăng tốc độ phản ứng điện phân.
Ứng Dụng Của Điện Phân Dung Dịch NaOH
Điện phân dung dịch NaOH có nhiều ứng dụng quan trọng trong công nghiệp và phòng thí nghiệm:
- Điều chế khí H₂ và O₂: Đây là phương pháp quan trọng để sản xuất khí hidro và oxy tinh khiết.
- Sản xuất nước Javel: Điện phân dung dịch NaCl (muối ăn) tạo ra nước Javel, một chất tẩy trắng và khử trùng.
- Nghiên cứu khoa học: Điện phân được sử dụng để nghiên cứu các phản ứng oxy hóa khử và các quá trình điện hóa.
Bài Tập Về Điện Phân Dung Dịch NaOH
Ví dụ 1:
Điện phân dung dịch NaOH với cường độ dòng điện 10A trong 268 giờ. Sau điện phân còn lại 100 gam dung dịch NaOH 24%. Tính nồng độ % của dung dịch NaOH trước điện phân.
Giải:
Quá trình điện phân thực chất là điện phân H₂O, làm tăng nồng độ NaOH.
Khối lượng NaOH trong dung dịch sau điện phân: mNaOH = 100g * 24% = 24g
Vậy trước điện phân, khối lượng NaOH cũng là 24g.
Số mol NaOH: nNaOH = 24/40 = 0.6 mol
Số mol H₂O bị điện phân:
n(H₂O) = (I t) / (2 F) = (10 268 3600) / (2 * 96500) = 50 mol
Khối lượng H₂O bị điện phân: m(H₂O) = 50 * 18 = 900g
Khối lượng dung dịch NaOH trước điện phân: mdd = 100 + 900 = 1000g
Nồng độ % của dung dịch NaOH trước điện phân: C% = (24/1000) * 100% = 2.4%
Ví dụ 2:
Điện phân 200ml dung dịch NaOH 1M với điện cực trơ, sau một thời gian thu được 2.24 lít khí O₂ (đktc) ở anot. Tính nồng độ NaOH sau điện phân (giả sử thể tích dung dịch không đổi).
Giải:
Số mol O₂ thu được: n(O₂) = 2.24 / 22.4 = 0.1 mol
Theo phương trình điện phân: 2H₂O → O₂↑ + 4H⁺ + 4e⁻, ta có n(H₂O) bị điện phân = 2 * n(O₂) = 0.2 mol
Ban đầu, số mol NaOH = 0.2 * 1 = 0.2 mol
Vì điện phân nước, số mol NaOH không đổi.
Thể tích dung dịch không đổi = 200ml = 0.2 lít
Nồng độ NaOH sau điện phân = 0.2 / 0.2 = 1M
Kết Luận
Điện phân dung dịch NaOH là một quá trình quan trọng, có nhiều ứng dụng trong công nghiệp và nghiên cứu. Hiểu rõ cơ chế và các yếu tố ảnh hưởng đến quá trình này giúp chúng ta ứng dụng nó một cách hiệu quả. Việc luyện tập các bài tập liên quan sẽ giúp củng cố kiến thức và kỹ năng giải quyết vấn đề.

