Este là một hợp chất hữu cơ quan trọng, được ứng dụng rộng rãi trong nhiều lĩnh vực. Việc nắm vững Danh Pháp Của Este là kiến thức cơ bản và cần thiết để học tốt môn Hóa học. Bài viết này sẽ cung cấp một hướng dẫn chi tiết về cách gọi tên este, các loại este phổ biến, cùng với các ví dụ minh họa cụ thể để bạn đọc dễ dàng nắm bắt.
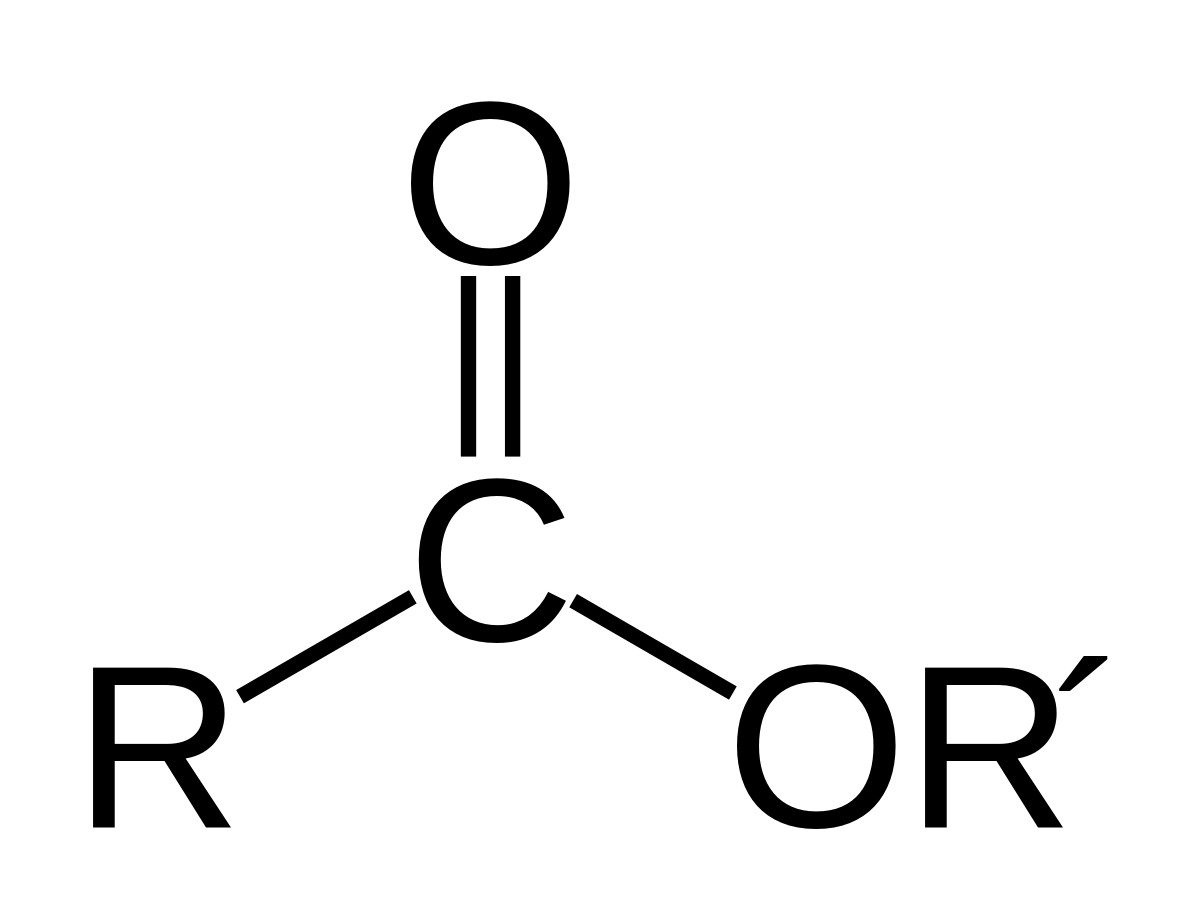
Este được tạo thành khi thay thế nhóm OH trong nhóm carboxyl của axit cacboxylic bằng nhóm OR. Công thức chung của este đơn chức là R-COO-R’, trong đó R là gốc hydrocarbon của axit (hoặc H đối với axit fomic) và R’ là gốc hydrocarbon của ancol (R’ khác H).
Công thức tổng quát của este no, đơn chức, mạch hở là CnH2nO2 (n ≥ 2).
Quy Tắc Gọi Tên Este (Danh Pháp IUPAC)
Tên của este được hình thành theo cấu trúc sau: Tên gốc hydrocarbon R’ (từ ancol) + Tên gốc axit (đuôi “at”).
Một số gốc axit thường gặp:
- HCOO-: Fomat (từ axit fomic HCOOH)
- CH3COO-: Axetat (từ axit axetic CH3COOH)
- CH2=CHCOO-: Acrylat (từ axit acrylic CH2=CHCOOH)
- C6H5COO-: Benzoat (từ axit benzoic C6H5COOH)
Tên một số gốc R’ thường gặp:
- CH3-: Metyl
- C2H5-: Etyl
- CH2=CH-: Vinyl
Ví dụ:
- HCOOC2H5: Etyl fomat
- CH3COOCH3: Metyl axetat
- CH2=CH-COO-CH3: Metyl acrylat
Danh Pháp Este Với Ancol Đa Chức
Đối với este tạo thành từ ancol đa chức, tên gọi được hình thành bằng cách kết hợp tên ancol và tên gốc axit.
Ví dụ: (CH3COO)2C2H4: Etylen glycol điaxetat
Phân Loại Este
Este có thể được phân loại dựa trên cấu trúc của gốc hydrocarbon và số lượng nhóm carboxyl.
- Este no, đơn chức: CnH2nO2 (n ≥ 2), tạo thành từ axit no, đơn chức và ancol no, đơn chức.
- Este không no, đơn chức: CmH2m+2-2kO2 (k ≥ 2), k là số liên kết pi trong phân tử.
- Este đa chức: Có thể tạo thành từ axit đơn chức và ancol đa chức, hoặc axit đa chức và ancol đơn chức, hoặc cả hai đều đa chức.
Tính Chất Vật Lý Của Este
- Trạng thái: Phần lớn là chất lỏng ở điều kiện thường, một số este có khối lượng phân tử lớn có thể ở trạng thái rắn (ví dụ: sáp ong).
- Nhiệt độ sôi: Thấp hơn so với ancol và axit cacboxylic có khối lượng phân tử tương đương do không tạo được liên kết hydrogen giữa các phân tử.
- Độ tan: Ít tan hoặc không tan trong nước do không tạo được liên kết hydrogen với nước.
- Mùi: Nhiều este có mùi thơm đặc trưng, được sử dụng trong công nghiệp thực phẩm và mỹ phẩm. Ví dụ, isoamyl axetat (CH3COOCH2CH2(CH3)2) có mùi chuối.
Tính Chất Hóa Học Quan Trọng Của Este
- Phản ứng thủy phân: Este bị thủy phân trong môi trường axit (xúc tác H+) hoặc bazơ (phản ứng xà phòng hóa).
- Thủy phân trong môi trường axit: RCOOR’ + H2O ⇌ RCOOH + R’OH
- Phản ứng xà phòng hóa: RCOOR’ + NaOH → RCOONa + R’OH
- Phản ứng khử: Este bị khử bởi LiAlH4 tạo thành ancol bậc nhất.
- Phản ứng cộng và trùng hợp: Este không no có thể tham gia phản ứng cộng với H2, Br2,… và phản ứng trùng hợp tương tự như anken.
Điều Chế Este
- Phản ứng este hóa: Đun hồi lưu axit cacboxylic với ancol, xúc tác H2SO4 đặc.
- RCOOH + R’OH ⇌ RCOOR’ + H2O
- Điều chế este của phenol: Cho anhidrit axit hoặc clorua axit tác dụng với phenol.
- (CH3CO)2O + C6H5OH → CH3COOC6H5 + CH3COOH
Ứng Dụng Của Este
- Dung môi: Nhiều este được sử dụng làm dung môi trong công nghiệp sơn và các ngành công nghiệp khác.
- Sản xuất polyme: Este là monome để sản xuất nhiều loại polyme quan trọng như poli(metyl acrylat), poli(vinyl axetat).
- Chất hóa dẻo: Một số este của axit phtalic được sử dụng làm chất hóa dẻo.
- Hương liệu: Nhiều este có mùi thơm đặc trưng, được sử dụng trong công nghiệp thực phẩm và mỹ phẩm.
Nhận Biết Este
- Este của axit fomic (HCOO-) có khả năng tham gia phản ứng tráng gương.
- Este không no làm mất màu dung dịch brom.
- Thủy phân este của glixerol hoặc chất béo tạo ra sản phẩm hòa tan Cu(OH)2.
Nắm vững danh pháp của este, cùng với các tính chất và ứng dụng của chúng, là kiến thức quan trọng giúp bạn học tốt môn Hóa học và hiểu rõ hơn về thế giới xung quanh. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và dễ hiểu về este.