Công thức Lewis là một công cụ quan trọng trong hóa học, giúp biểu diễn sự liên kết giữa các nguyên tử trong một phân tử và vị trí của các electron hóa trị. Trong bài viết này, chúng ta sẽ tập trung vào việc xây dựng công thức Lewis cho phân tử Boron trifluoride (BF3) một cách chi tiết và dễ hiểu.
Để vẽ công thức Lewis cho BF3, chúng ta cần tuân theo một số bước cơ bản.
Bước 1: Xác định tổng số electron hóa trị
Đầu tiên, xác định số electron hóa trị của mỗi nguyên tử trong phân tử. Boron (B) có 3 electron hóa trị và Fluorine (F) có 7 electron hóa trị. Vì BF3 có một nguyên tử B và ba nguyên tử F, tổng số electron hóa trị là:
N1 = (1 x 3) + (3 x 7) = 3 + 21 = 24 electron
Bước 2: Vẽ khung liên kết giữa các nguyên tử
Boron là nguyên tử trung tâm và liên kết với ba nguyên tử Fluorine. Mỗi liên kết đơn sử dụng 2 electron. Do đó, số electron hóa trị được sử dụng để tạo khung liên kết là:
N2 = 3 x 2 = 6 electron
Bước 3: Phân phối các electron còn lại để hoàn thành octet (quy tắc bát tử)
Số electron hóa trị còn lại sau khi tạo khung là:
N3 = N1 – N2 = 24 – 6 = 18 electron
Chúng ta sử dụng 18 electron này để tạo octet cho các nguyên tử Fluorine trước, vì Fluorine có độ âm điện cao hơn Boron. Mỗi nguyên tử F cần 6 electron để hoàn thành octet.
Bước 4: Kiểm tra và hoàn thiện công thức Lewis
Sau khi phân phối electron cho các nguyên tử xung quanh, ta thấy rằng mỗi nguyên tử Fluorine đã có 8 electron (octet), nhưng nguyên tử Boron chỉ có 6 electron. Boron là một trường hợp ngoại lệ của quy tắc octet, nó ổn định với ít hơn 8 electron trong lớp vỏ hóa trị.
Do đó, công thức Lewis của BF3 có thể được biểu diễn như sau:
Lưu ý quan trọng về BF3:
- BF3 là một phân tử thiếu electron, có nghĩa là nguyên tử Boron không có octet hoàn chỉnh. Điều này làm cho BF3 trở thành một acid Lewis mạnh, có khả năng nhận một cặp electron từ một base Lewis để tạo thành một liên kết phối trí.
- Do tính chất thiếu electron, BF3 dễ dàng phản ứng với các phân tử giàu electron để đạt được cấu trúc bền vững hơn.
Ví dụ minh họa khác về công thức Lewis
Để hiểu rõ hơn về cách vẽ công thức Lewis, chúng ta cùng xem xét một ví dụ khác: Công thức Lewis của CH4 (Methane).
Bước 1: Tính tổng số electron hóa trị. Carbon (C) có 4 electron hóa trị và Hydrogen (H) có 1 electron hóa trị.
N1 = (1 x 4) + (4 x 1) = 8 electron
Bước 2: Vẽ khung liên kết. Carbon là nguyên tử trung tâm và liên kết với bốn nguyên tử Hydrogen.
N2 = 4 x 2 = 8 electron
Bước 3: Phân phối các electron còn lại. Trong trường hợp này, không còn electron nào để phân phối (N3 = 0).
Vậy công thức Lewis của CH4 là:
Công thức Lewis của SO3
Xét phân tử SO3, lưu huỳnh (S) có 6 electron hóa trị, oxy (O) cũng có 6 electron hóa trị.
Bước 1: Tính tổng số electron hóa trị: N1 = (1 x 6) + (3 x 6) = 24 electron
Bước 2: Vẽ khung liên kết: S là trung tâm, liên kết với 3 nguyên tử O. N2 = 3 x 2 = 6 electron
Bước 3: Số electron còn lại: N3 = 24 – 6 = 18 electron. Phân phối electron để tạo octet cho O trước.
Bước 4: S chưa đủ octet, chuyển một cặp electron từ O tạo liên kết đôi.
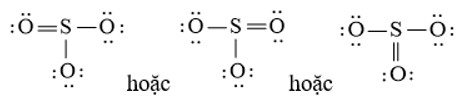 Công thức Lewis của SO3 với liên kết đôi giữa Lưu huỳnh và một Oxy
Công thức Lewis của SO3 với liên kết đôi giữa Lưu huỳnh và một Oxy
Công thức Lewis của F2O
Fluorine (F) có 7 electron hóa trị, Oxy (O) có 6 electron hóa trị.
Bước 1: Tổng số electron hóa trị: N1 = (2 x 7) + (1 x 6) = 20 electron
Bước 2: Vẽ khung liên kết: O là trung tâm, liên kết với 2 nguyên tử F. Số electron đã dùng: N2 = 2 x 2 = 4 electron
Bước 3: Số electron còn lại: N3 = 20 – 4 = 16 electron. Phân phối electron để tạo octet cho F trước, sau đó đến O.
Hy vọng qua bài viết này, bạn đã hiểu rõ hơn về cách vẽ công thức Lewis, đặc biệt là công thức Lewis của BF3 và các ví dụ minh họa khác. Việc nắm vững công thức Lewis giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các phân tử.

