Công thức electron của SO2 (lưu huỳnh đioxit) là một khái niệm quan trọng trong hóa học, đặc biệt khi nghiên cứu về cấu trúc phân tử và liên kết hóa học. Bài viết này sẽ cung cấp một cái nhìn chi tiết và dễ hiểu về công thức electron của SO2, giúp bạn nắm vững kiến thức và áp dụng vào giải các bài tập liên quan.
SO2 là một hợp chất được hình thành từ một nguyên tử lưu huỳnh (S) và hai nguyên tử oxy (O). Để viết được công thức electron của SO2, ta cần xác định số electron hóa trị của mỗi nguyên tử.
- Lưu huỳnh (S) thuộc nhóm VIA, có 6 electron hóa trị.
- Oxy (O) thuộc nhóm VIA, có 6 electron hóa trị.
Tổng số electron hóa trị trong phân tử SO2 là: 6 (S) + 2 x 6 (O) = 18 electron.
Để vẽ công thức electron, ta tuân theo các bước sau:
- Xác định nguyên tử trung tâm: Trong SO2, lưu huỳnh (S) là nguyên tử trung tâm vì độ âm điện của S nhỏ hơn O.
- Vẽ liên kết đơn giữa nguyên tử trung tâm và các nguyên tử xung quanh: S liên kết với hai nguyên tử O bằng hai liên kết đơn.
- Điền electron còn lại vào các nguyên tử xung quanh để đạt octet: Mỗi nguyên tử O cần thêm 6 electron để đạt octet (8 electron lớp ngoài cùng).
- Kiểm tra octet của nguyên tử trung tâm: Lưu huỳnh có thể mở rộng octet.
Kết quả, ta có công thức electron của SO2 như sau:
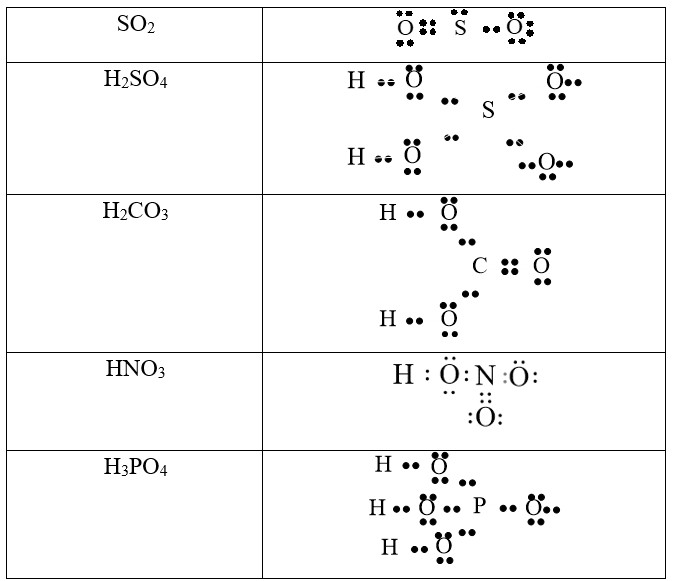 Công thức electron SO2 đầy đủ: Lưu huỳnh liên kết với hai oxy bằng liên kết đôi và liên kết cho nhận, biểu diễn rõ các cặp electron tự do.
Công thức electron SO2 đầy đủ: Lưu huỳnh liên kết với hai oxy bằng liên kết đôi và liên kết cho nhận, biểu diễn rõ các cặp electron tự do.
Giải thích công thức electron SO2:
- Mỗi nguyên tử oxy liên kết với lưu huỳnh bằng một liên kết đôi (2 electron).
- Một nguyên tử oxy liên kết với lưu huỳnh bằng một liên kết cho nhận, trong đó lưu huỳnh cung cấp cả hai electron cho liên kết.
- Nguyên tử lưu huỳnh còn một cặp electron tự do.
Cộng hưởng trong SO2:
Do có liên kết cho nhận, SO2 thể hiện hiện tượng cộng hưởng. Điều này có nghĩa là cấu trúc thực tế của SO2 là trung bình cộng của hai cấu trúc cộng hưởng:
O=S→O ↔ O←S=O
Hiện tượng cộng hưởng giúp giải thích tính chất hóa học của SO2, đặc biệt là khả năng phản ứng của nó.
Ý nghĩa của công thức electron SO2:
- Dự đoán cấu trúc phân tử: Công thức electron giúp ta hình dung được hình dạng phân tử SO2 (góc).
- Giải thích tính chất hóa học: Nó giải thích tại sao SO2 là một chất khí có tính khử và có khả năng tham gia vào nhiều phản ứng hóa học quan trọng.
- Hiểu rõ liên kết hóa học: Công thức electron làm sáng tỏ bản chất của liên kết cộng hóa trị và liên kết cho nhận trong phân tử SO2.
Ứng dụng của SO2:
SO2 có nhiều ứng dụng quan trọng trong công nghiệp và đời sống, bao gồm:
- Sản xuất axit sulfuric (H2SO4): SO2 là nguyên liệu chính trong quy trình sản xuất H2SO4, một hóa chất quan trọng trong nhiều ngành công nghiệp.
- Chất bảo quản thực phẩm: SO2 được sử dụng để bảo quản trái cây khô và các loại thực phẩm khác, ngăn chặn sự phát triển của vi khuẩn và nấm mốc.
- Tẩy trắng: SO2 có khả năng tẩy trắng giấy, vải và các vật liệu khác.
- Sát trùng: SO2 được sử dụng để khử trùng các thiết bị và không gian.
Tuy nhiên, SO2 cũng là một chất gây ô nhiễm môi trường, góp phần vào hiện tượng mưa axit và các vấn đề về sức khỏe.
Kết luận:
Hiểu rõ công thức electron của SO2 không chỉ giúp bạn nắm vững kiến thức hóa học mà còn giúp bạn hiểu rõ hơn về cấu trúc, tính chất và ứng dụng của hợp chất này trong thực tế. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và dễ hiểu về công thức electron của SO2.

