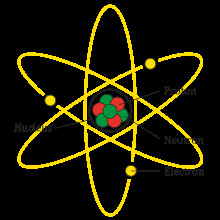
Nguyên Tố Hóa Học và Đồng Vị
Để hiểu rõ Công Thức đồng Vị Bền, trước tiên cần nắm vững các khái niệm cơ bản về nguyên tử, nguyên tử khối và đồng vị.
Nguyên tử: Đơn vị cơ bản cấu tạo nên vật chất, gồm hạt nhân (proton và neutron) và các electron quay xung quanh.
Alt: Mô hình nguyên tử Heli với 2 proton, 2 neutron trong hạt nhân và 2 electron quay quanh, thể hiện cấu trúc cơ bản của nguyên tử.
Nguyên tử khối: Khối lượng của một nguyên tử, đo bằng đơn vị đvC (đơn vị carbon). Nguyên tử khối xấp xỉ bằng tổng khối lượng proton và neutron.
Đồng vị: Các dạng khác nhau của cùng một nguyên tố hóa học, có cùng số proton nhưng khác số neutron, do đó khác số khối.
Alt: Bảng tuần hoàn các nguyên tố hóa học, hiển thị ký hiệu hóa học, số hiệu nguyên tử và nguyên tử khối trung bình, thông tin quan trọng trong tính toán đồng vị.
Đồng Vị Bền và Đồng Vị Phóng Xạ
Đồng vị bền: Là các đồng vị không tự phân rã theo thời gian, tồn tại ổn định trong tự nhiên.
Đồng vị phóng xạ: Là các đồng vị không ổn định, tự phân rã và phát ra các hạt hoặc tia phóng xạ.
Nguyên tử khối trung bình: Do các nguyên tố tồn tại ở nhiều dạng đồng vị, nguyên tử khối được sử dụng thường là nguyên tử khối trung bình, tính đến tỷ lệ phần trăm của mỗi đồng vị.
Công Thức Tính Phần Trăm Đồng Vị Bền
Công thức tính nguyên tử khối trung bình dựa trên phần trăm các đồng vị:
$M = frac{x_1 cdot M_1 + x_2 cdot M_2 + … + x_n cdot M_n}{100}$
Trong đó:
- $M$: Nguyên tử khối trung bình của nguyên tố.
- $M_1, M_2, …, M_n$: Nguyên tử khối của các đồng vị.
- $x_1, x_2, …, x_n$: Phần trăm số nguyên tử của mỗi đồng vị (%).
Để tính phần trăm của các đồng vị, ta có thể sử dụng phương pháp sau:
- Gọi phần trăm của một đồng vị là $x$%.
- Phần trăm của đồng vị còn lại sẽ là $(100 – x)$%.
- Thay các giá trị vào công thức tính nguyên tử khối trung bình và giải phương trình để tìm $x$.
Alt: Ba đồng vị của Neon (Ne-20, Ne-21, Ne-22) minh họa sự khác biệt về số neutron trong hạt nhân, ảnh hưởng đến khối lượng nguyên tử.
Ví Dụ Minh Họa
Ví dụ 1: Tính thành phần phần trăm các đồng vị của đồng, biết đồng có hai đồng vị là $^{63}{29}Cu$ và $^{65}{29}Cu$, và nguyên tử khối trung bình của đồng là 63,54.
Giải:
Gọi $x$ là phần trăm của đồng vị $^{63}{29}Cu$. Suy ra phần trăm của đồng vị $^{65}{29}Cu$ là $(100 – x)$.
Ta có:
$63.54 = frac{63x + 65(100 – x)}{100}$
$6354 = 63x + 6500 – 65x$
$2x = 146$
$x = 73$%
Vậy, đồng vị $^{63}{29}Cu$ chiếm 73% và đồng vị $^{65}{29}Cu$ chiếm 27%.
Bài Tập Vận Dụng
Bài 1: Trong tự nhiên, cacbon có hai đồng vị bền: $^{12}_6C$ (98,89%) và $^{13}_6C$ (1,11%). Tính nguyên tử khối trung bình của cacbon.
Giải:
$M_C = frac{12 cdot 98.89 + 13 cdot 1.11}{100} = 12.0111$
Bài 2: Clo có hai đồng vị là $^{35}{17}Cl$ và $^{37}{17}Cl$. Nguyên tử khối trung bình của clo là 35,5. Tính phần trăm khối lượng của $^{37}_{17}Cl$ trong hợp chất $HClO_4$ (H là $^{1}_1H$, O là $^{16}_8O$).
Giải:
Gọi $x$ là phần trăm của $^{35}{17}Cl$. Suy ra phần trăm của $^{37}{17}Cl$ là $(100 – x)$.
$35.5 = frac{35x + 37(100 – x)}{100}$
$3550 = 35x + 3700 – 37x$
$2x = 150$
$x = 75$%
Vậy, $^{35}{17}Cl$ chiếm 75% và $^{37}{17}Cl$ chiếm 25%.
Phân tử khối của $HClO_4 = 1 + 35.5 + 4 cdot 16 = 100.5$
Phần trăm khối lượng của $^{37}_{17}Cl$ trong $HClO_4$ là:
$frac{37 cdot 25}{100 cdot 100.5} cdot 100% = 9.2%$
Bài 3: Nguyên tố A có hai đồng vị với tỉ lệ số nguyên tử là 27:23. Hạt nhân nguyên tử A chứa 35 proton. Đồng vị thứ nhất có 44 neutron và ít hơn đồng vị thứ hai 2 neutron. Tính nguyên tử khối trung bình của A.
Giải:
Đồng vị 1: Số khối = 35 + 44 = 79
Đồng vị 2: Số neutron = 44 + 2 = 46. Số khối = 35 + 46 = 81
$M_A = frac{79 cdot 27 + 81 cdot 23}{27 + 23} = 79.92$
Bài 4: Oxi có ba đồng vị: $^{16}_8O$ (99,757%), $^{17}_8O$ (0,039%), $^{18}_8O$ (0,204%).
a) Tính khối lượng nguyên tử trung bình của oxi.
b) Có thể tạo thành tối đa bao nhiêu loại phân tử $O_2$?
Giải:
a) $M_O = frac{16 cdot 99.757 + 17 cdot 0.039 + 18 cdot 0.204}{100} = 16.0044$
b) Số loại phân tử $O_2$ tối đa là: 3 x 3 = 9 loại.
Bài 5: Bo có nguyên tử khối trung bình là 10,81. Trong tự nhiên, bo có hai đồng vị là $^{10}B$ và $^{11}B$. Tính phần trăm khối lượng của đồng vị $^{11}B$ trong hợp chất axit $HBO_3$ (M = 61,81).
Giải:
Gọi x là % của $^{10}B$, thì (100-x) là % của $^{11}B$
Ta có: $frac{10x + 11(100-x)}{100} = 10.81$
=> $x = 19$
=> % của $^{10}B = 19%$ và % của $^{11}B = 81%$
Phần trăm khối lượng của $^{11}B$ trong $HBO_3$:
$frac{11 81}{61.81 100} = 14.41%$
Ứng Dụng của Đồng Vị Bền
- Địa chất học: Xác định tuổi của các mẫu vật địa chất, nghiên cứu quá trình hình thành Trái Đất.
- Khảo cổ học: Xác định tuổi của các di vật cổ.
- Y học: Sử dụng trong chẩn đoán và điều trị bệnh.
- Nông nghiệp: Nghiên cứu quá trình hấp thụ dinh dưỡng của cây trồng.
- Môi trường: Theo dõi ô nhiễm môi trường.
Kết Luận
Nắm vững công thức và cách tính phần trăm đồng vị bền là kiến thức quan trọng trong hóa học. Việc luyện tập các bài tập vận dụng giúp củng cố kiến thức và kỹ năng giải bài tập liên quan.