Este là một hợp chất hữu cơ quan trọng, có nhiều ứng dụng trong đời sống và công nghiệp. Để hiểu rõ về este, đặc biệt là Công Thức Chung Của Este No đơn Chức Mạch Hở Là gì, chúng ta cùng tìm hiểu chi tiết qua bài viết sau.
Este Là Gì? Định Nghĩa Và Công Thức Tổng Quát
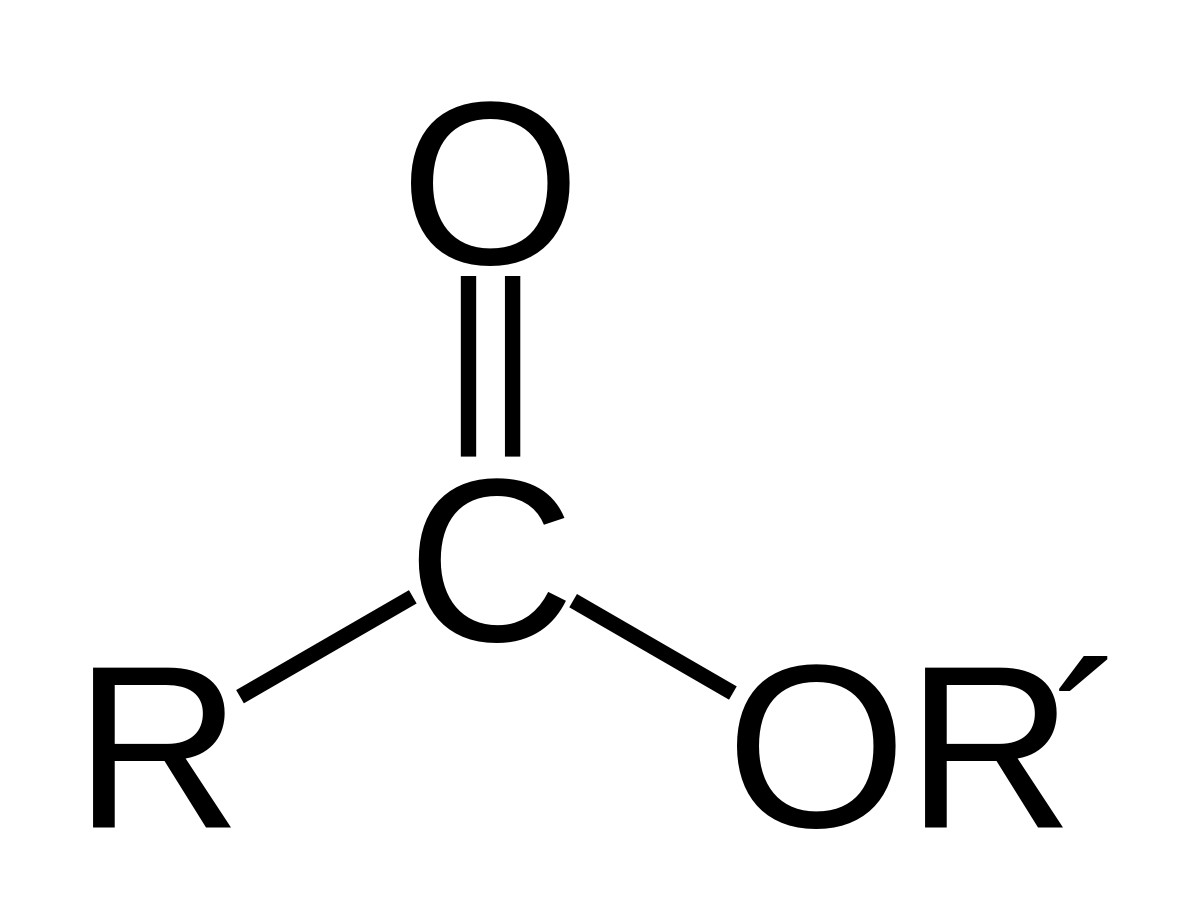
Este là sản phẩm thu được khi thay thế nhóm OH trong nhóm carboxyl của axit cacboxylic bằng nhóm OR.
Công thức chung của este no đơn chức mạch hở là:
- CnH2nO2 (n ≥ 2)
- R-COO-R’
Trong đó:
- R là gốc hidrocacbon của axit (hoặc H đối với axit fomic).
- R’ là gốc hidrocacbon của ancol.
- n là số nguyên tử cacbon trong phân tử este.
Ảnh: Cấu trúc phân tử este, minh họa nhóm chức và các gốc hidrocacbon.
Cách Gọi Tên Este (Danh Pháp)
Tên este được hình thành theo cấu trúc: Tên gốc hidrocacbon R’ + Tên gốc axit (đuôi “at”).
Ví dụ:
- HCOOC2H5: Etyl fomat
- CH3COOCH3: Metyl axetat
Ảnh: Ví dụ về công thức cấu tạo và tên gọi của một số este thông dụng.
Phân Loại Este
Dựa vào cấu tạo, este được phân thành nhiều loại:
- Este no, đơn chức, mạch hở: CnH2nO2 (n ≥ 2)
- Este không no, đơn chức, mạch hở: CmH2m+2-2kO2 (k ≥ 2)
- Este đa chức: (RCOO)mR’, R(COOR’)m, Rm(COO)nmR’n
Ảnh: Công thức cấu tạo của các loại este khác nhau.
Tính Chất Vật Lý Của Este
- Trạng thái: Thường là chất lỏng, một số este có khối lượng phân tử lớn ở trạng thái rắn.
- Nhiệt độ sôi: Thấp hơn so với ancol và axit cacboxylic có cùng số nguyên tử cacbon.
- Độ tan: Ít tan hoặc không tan trong nước.
- Mùi: Nhiều este có mùi thơm đặc trưng (ví dụ: isoamyl axetat – mùi chuối, etyl butirat – mùi dứa).
Tính Chất Hóa Học Của Este
- Phản ứng thủy phân:
- Trong môi trường axit: RCOOR’ + H2O ⇌ RCOOH + R’OH
- Trong môi trường kiềm (phản ứng xà phòng hóa): RCOOR’ + NaOH → RCOONa + R’OH
- Phản ứng khử: Este bị khử bởi LiAlH4 tạo thành ancol bậc I.
- Phản ứng cộng: Este không no có thể tham gia phản ứng cộng với H2, Br2,…
- Phản ứng trùng hợp: Một số este có liên kết C=C tham gia phản ứng trùng hợp.
Ảnh: Phản ứng khử este bằng liti nhôm hiđrua (LiAlH4).
Điều Chế Este
- Phản ứng este hóa: RCOOH + R’OH ⇌ RCOOR’ + H2O (xúc tác H2SO4 đặc, nhiệt độ)
- Este của phenol: Điều chế từ anhidrit axit hoặc clorua axit tác dụng với phenol.
- Este không no: RCOOH + HC≡CH → RCOOCH=CH2
Ảnh: Sơ đồ phản ứng điều chế este.
Ứng Dụng Của Este
- Dung môi: Pha sơn, keo dán.
- Sản xuất polime: Poli(metyl acrylat), poli(vinyl axetat).
- Chất hóa dẻo: Este của axit phtalic.
- Hương liệu, mỹ phẩm: Tạo mùi thơm cho thực phẩm, nước hoa.
Ảnh: Ứng dụng của este làm hương liệu thực phẩm.
Ảnh: Ứng dụng của este trong công nghiệp mỹ phẩm.
Nhận Biết Este
- Este của axit fomic (HCOO-) có phản ứng tráng gương.
- Este không no làm mất màu dung dịch brom.
- Thủy phân este tạo bởi glixerol cho sản phẩm hòa tan Cu(OH)2.
Nắm vững kiến thức về este, đặc biệt là công thức chung của este no đơn chức mạch hở là CnH2nO2 (n ≥ 2), giúp các bạn học sinh dễ dàng giải quyết các bài tập hóa học liên quan và hiểu rõ hơn về ứng dụng của chúng trong thực tế.