CO3, hay chính xác hơn là CO3²⁻, mang hóa trị 2. Đây là ion cacbonat, một thành phần quan trọng trong nhiều hợp chất hóa học. Công thức hóa học CO3²⁻ cho thấy ion này có điện tích âm 2, thể hiện khả năng liên kết với hai ion dương đơn hóa trị hoặc một ion dương lưỡng hóa trị. Ion cacbonat là gốc của axit cacbonic (H2CO3), một axit yếu. Các kim loại kiềm và kiềm thổ thường tạo thành các hợp chất với ion cacbonat.
Cấu trúc của CO3²⁻ tuân theo quy tắc octet, đảm bảo sự ổn định của phân tử. Trong cấu trúc này, các nguyên tử oxy có số oxi hóa âm, cho thấy chúng nhận electron từ nguyên tử carbon. Hóa trị của CO3²⁻ cho phép nó kết hợp với hai nguyên tử hydro để tạo thành axit cacbonic.
Tính Chất Hóa Học Đặc Trưng Của Muối Cacbonat (CO3²⁻)
Tác Dụng Với Axit: Giải Phóng Khí CO2
Muối cacbonat phản ứng với các axit mạnh hơn axit cacbonic (H2CO3), tạo thành muối mới và giải phóng khí CO2. Phản ứng này thường đi kèm với hiện tượng sủi bọt do khí CO2 thoát ra.
Ví dụ minh họa:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Tác Dụng Với Bazơ: Tạo Kết Tủa
Một số dung dịch muối cacbonat có khả năng tác dụng với dung dịch bazơ, tạo thành muối cacbonat không tan (kết tủa) và bazơ mới. Điều này phụ thuộc vào độ tan của muối cacbonat tạo thành.
Ví dụ minh họa:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Muối hiđrocacbonat (chứa ion HCO3⁻) phản ứng với dung dịch kiềm, tạo thành muối trung hòa và nước.
Ví dụ minh họa:
NaHCO3 (dd) + NaOH (dd) → Na2CO3 (dd) + H2O (l)
 Phản ứng của muối cacbonat với axit và bazơ
Phản ứng của muối cacbonat với axit và bazơ
Alt: Sơ đồ minh họa phản ứng hóa học của muối cacbonat (CO3 2-) với axit clohydric (HCl) tạo ra khí CO2 và phản ứng của muối cacbonat với bazo tạo thành kết tủa.
Tác Dụng Với Dung Dịch Muối: Phản Ứng Trao Đổi
Dung dịch muối cacbonat có thể tác dụng với một số dung dịch muối khác, tạo ra hai muối mới thông qua phản ứng trao đổi ion. Phản ứng này thường xảy ra khi một trong hai muối mới tạo thành là chất kết tủa.
Ví dụ minh họa: Dung dịch natri cacbonat (Na2CO3) tác dụng với dung dịch canxi clorua (CaCl2) tạo thành kết tủa trắng canxi cacbonat (CaCO3).
Na2CO3 + CaCl2 → CaCO3 (rắn – trắng) + 2NaCl (dd)
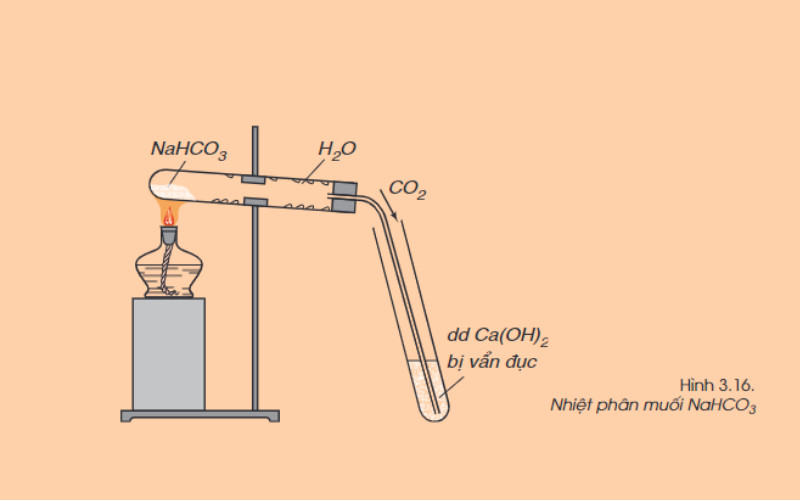
Phản Ứng Nhiệt Phân: Phân Hủy Tạo Oxit và CO2
Nhiều muối cacbonat bị nhiệt phân hủy, giải phóng khí cacbonic (CO2) và tạo thành oxit kim loại tương ứng. Nhiệt độ cần thiết để phân hủy khác nhau tùy thuộc vào loại muối cacbonat.
Ví dụ minh họa:
CaCO3 → CaO + CO2
2NaHCO3 → Na2CO3 + H2O + CO2
Ứng Dụng Rộng Rãi Của Muối Cacbonat Trong Đời Sống Và Sản Xuất
Muối cacbonat đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ đời sống hàng ngày đến sản xuất công nghiệp.
Canxi Cacbonat (CaCO3): Vật Liệu Xây Dựng và Phụ Gia Quan Trọng
- Công nghiệp xây dựng: Sử dụng rộng rãi làm đá xây dựng, cẩm thạch và là thành phần chính của xi măng.
- Ngành sơn: Dùng làm chất độn chính, giúp tăng độ phủ và giảm chi phí sản xuất.
- Sản xuất vật liệu: Ứng dụng trong sản xuất tấm trần, khung nhựa, ống PVC, v.v.
Natri Cacbonat (Na2CO3) – Soda: Sản Xuất Thủy Tinh và Chất Tẩy Rửa
- Sản xuất thủy tinh: Chiếm tỉ lệ lớn trong thành phần nguyên liệu sản xuất thủy tinh (13-15%).
- Chất phụ gia: Sử dụng trong xà phòng, chất tẩy rửa, giúp tăng hiệu quả làm sạch.
- Nguyên liệu hóa chất: Là nguyên liệu để sản xuất nhiều hóa chất gốc natri khác.
- Xử lý nước thải: Tăng độ kiềm và pH trong nước thải, hỗ trợ vi sinh vật phát triển và xử lý ô nhiễm nitơ.
Natri Bicarbonat (NaHCO3) – Baking Soda: Thực Phẩm, Dược Phẩm và Nuôi Trồng Thủy Sản
- Thực phẩm: Tạo độ giòn, xốp cho bánh, được sử dụng phổ biến trong làm bánh.
- Dược phẩm: Tạo bọt và tăng PH trong một số loại thuốc, ví dụ như thuốc nhức đầu.
- Vệ sinh răng miệng: Phòng ngừa sâu răng, mòn răng và các bệnh nha chu.
- Điều trị bệnh: Trung hòa acid dịch vị, chữa bệnh trào ngược dạ dày.
- Nuôi trồng thủy sản: Tăng độ kiềm trong nước, tạo môi trường sống tốt cho các loài thủy sản.
