A. Tổng Quan Về Chuỗi Phản Ứng Của Fe
Sắt (Fe) là một kim loại chuyển tiếp quan trọng, tham gia vào nhiều phản ứng hóa học khác nhau. Việc nắm vững các tính chất hóa học của Fe và các hợp chất của nó là điều cần thiết để giải quyết các bài toán liên quan đến chuỗi phản ứng. Dưới đây là một số phản ứng quan trọng thường gặp trong Chuỗi Phản ứng Của Fe:
- Phản ứng với phi kim: Fe tác dụng với các phi kim như O2, Cl2, S tạo thành oxit hoặc muối.
- Phản ứng với axit: Fe phản ứng với các axit HCl, H2SO4 loãng giải phóng khí H2 và tạo thành muối Fe(II). Với HNO3 hoặc H2SO4 đặc nóng, Fe tạo thành muối Fe(III), khí NO2 hoặc SO2 và H2O.
- Phản ứng với dung dịch muối: Fe có thể khử các ion kim loại yếu hơn trong dung dịch muối của chúng.
- Phản ứng oxi hóa – khử: Fe và các hợp chất của nó có thể thể hiện tính khử hoặc tính oxi hóa tùy thuộc vào điều kiện phản ứng.
B. Các Ví Dụ Minh Họa Chuỗi Phản Ứng Của Fe
Để hiểu rõ hơn về chuỗi phản ứng của Fe, chúng ta sẽ xem xét một số ví dụ cụ thể:
Ví dụ 1: Hoàn thành chuỗi phản ứng sau:
Fe → FeCl3 → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe
Giải:
(1) 2Fe + 3Cl2 → 2FeCl3
(2) 2FeCl3 + Fe → 3FeCl2
(3) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
(4) 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
(5) 2Fe(OH)3 → Fe2O3 + 3H2O (điều kiện: nhiệt độ)
(6) Fe2O3 + 3CO → 2Fe + 3CO2 (điều kiện: nhiệt độ)
Ví dụ 2: Cho sơ đồ phản ứng sau:
FeS2 → X → Y → Z → Fe
Xác định các chất X, Y, Z và viết các phương trình phản ứng.
Giải:
Các chất X, Y, Z lần lượt là Fe2O3, Fe3O4, FeO.
(1) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 (điều kiện: nhiệt độ)
(2) 3Fe2O3 + CO → 2Fe3O4 + CO2 (điều kiện: nhiệt độ)
(3) Fe3O4 + CO → 3FeO + CO2 (điều kiện: nhiệt độ)
(4) FeO + CO → Fe + CO2 (điều kiện: nhiệt độ)
Ví dụ 3: Hoàn thành chuỗi phản ứng sau và cho biết vai trò của Fe trong mỗi phản ứng:
Fe + HCl → A + …
A + NaOH → B + …
B + O2 + H2O → C
C → D + H2O
D + CO → Fe + …
Giải:
A: FeCl2, B: Fe(OH)2, C: Fe(OH)3, D: Fe2O3
- Fe + 2HCl → FeCl2 + H2 (Fe đóng vai trò chất khử)
- FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
- 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (Fe(OH)2 đóng vai trò chất khử)
- 2Fe(OH)3 → Fe2O3 + 3H2O (điều kiện: nhiệt độ)
- Fe2O3 + 3CO → 2Fe + 3CO2 (Fe2O3 đóng vai trò chất oxi hóa)
Ví dụ 4: Xác định các chất và hoàn thành sơ đồ phản ứng sau:
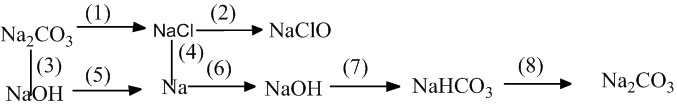 Chuỗi phản ứng hóa học của kim loại thể hiện mối liên hệ giữa các hợp chất của sắt
Chuỗi phản ứng hóa học của kim loại thể hiện mối liên hệ giữa các hợp chất của sắt
Giải:
(1) Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
(2) 2NaCl + 2H2O → 2NaOH + H2 + Cl2 (điều kiện: điện phân dung dịch có màng ngăn)
(3) Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
(4) 2NaCl → 2Na + Cl2 (điều kiện: điện phân nóng chảy)
(5) 4NaOH → 4Na + O2 + 2H2O (điều kiện: điện phân nóng chảy)
(6) 2Na + 2H2O → 2NaOH + H2
(7) NaOH + CO2 → NaHCO3
(8) NaHCO3 + NaOH → Na2CO3 + H2O
C. Bài Tập Trắc Nghiệm Về Chuỗi Phản Ứng Của Fe
Câu 1: Cho các chất: Fe, FeCl2, FeCl3, FeSO4, Fe2(SO4)3, FeO, Fe2O3. Số chất vừa có tính oxi hóa, vừa có tính khử là:
A. 3
B. 4
C. 5
D. 6
Đáp án: B. FeO, FeCl2, FeSO4, Fe3O4
Câu 2: Cho sơ đồ sau:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe → FeCl3.
Số phương trình phản ứng oxi hóa – khử trong dãy là:
A. 3
B. 4
C. 5
D. 6
Đáp án: B
Câu 3: Để khử ion Fe3+ trong dung dịch thành ion Fe2+, có thể dùng dư chất nào sau đây?
A. Mg
B. Cu
C. Ba
D. Na
Đáp án: B
Câu 4: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng oxi hóa – khử là:
A. 5
B. 6
C. 7
D. 8
Đáp án: C
Câu 5: Cho sơ đồ sau: FeS2 → X → Y → Z → Fe
Các chất X, Y, Z lần lượt là:
A. FeS, Fe2O3, FeO.
B. Fe3O4, Fe2O3, FeO.
C. Fe2O3, Fe3O4, FeO.
D. FeO, Fe3O4, Fe2O3.
Đáp án: C
D. Lời Kết
Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn tổng quan và chi tiết về chuỗi phản ứng của Fe. Việc nắm vững các kiến thức này sẽ giúp bạn tự tin hơn khi giải các bài tập hóa học liên quan. Chúc các bạn học tốt!
