Bài toán về phản ứng của hỗn hợp kim loại với axit là một dạng bài tập quan trọng trong chương trình hóa học phổ thông. Để giải quyết bài toán này, cần nắm vững các kiến thức về tính chất hóa học của kim loại, axit, và các định luật bảo toàn. Bài viết này sẽ đi sâu vào phân tích một bài toán điển hình: phản ứng của 12 gam hỗn hợp Al và Fe với dung dịch HCl.
Cho 12 Gam hỗn hợp X gồm Al và Fe vào 100ml dung dịch HCl 2M đến phản ứng hoàn toàn thu được khí H2 và 7,0 gam chất rắn chưa tan. Thể tích dung dịch HCl 2M tối thiểu cần dùng để hòa tan hết 12 gam hỗn hợp X là bao nhiêu?
Để giải quyết bài toán này, chúng ta cần phân tích kỹ các dữ kiện và diễn biến của phản ứng.
- Kim loại phản ứng với HCl: Cả Al và Fe đều phản ứng với HCl tạo thành muối clorua và khí H2. Tuy nhiên, thứ tự phản ứng cần được xem xét.
- Chất rắn không tan: Dữ kiện này cho biết Fe còn dư sau phản ứng. Điều này có nghĩa là Al đã phản ứng hết trước khi Fe phản ứng hoàn toàn.
- Tính toán số mol: Dựa vào lượng chất rắn không tan, ta có thể tính được số mol Fe dư. Từ đó, suy ra số mol Fe đã phản ứng. Sử dụng số mol các chất đã phản ứng, ta tính được số mol HCl cần thiết.
Lời giải chi tiết sẽ được trình bày dưới đây.
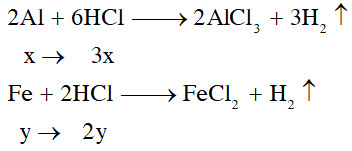 Phản ứng của Al và Fe với HCl
Phản ứng của Al và Fe với HCl
Phản ứng hóa học giữa Al, Fe và dung dịch axit clohidric (HCl) tạo thành muối clorua và giải phóng khí hidro.
Giả sử trong 12 gam hỗn hợp X có x mol Al và y mol Fe. Ta có hệ phương trình:
- 27x + 56y = 12 (1)
Vì sau phản ứng còn 7 gam Fe không tan, nên số mol Fe phản ứng là y – (7/56) = y – 0.125 mol.
Các phương trình hóa học xảy ra:
-
2Al + 6HCl → 2AlCl3 + 3H2
-
x —-> 3x
-
Fe + 2HCl → FeCl2 + H2
-
(y-0.125) —-> 2(y-0.125)
Số mol HCl đã dùng là 0.1 * 2 = 0.2 mol. Ta có phương trình:
- 3x + 2(y-0.125) = 0.2 (2)
Giải hệ phương trình (1) và (2), ta được: x = 0.1 và y = 0.1625
Để hòa tan hết 12 gam hỗn hợp X, ta có các phương trình phản ứng:
-
2Al + 6HCl → 2AlCl3 + 3H2
-
0.1 —-> 0.3
-
Fe + 2HCl → FeCl2 + H2
-
0.1625 —-> 0.325
Vậy tổng số mol HCl cần dùng là 0.3 + 0.325 = 0.625 mol. Thể tích dung dịch HCl 2M cần dùng là: V = 0.625 / 2 = 0.3125 lít = 312.5 ml
Sơ đồ minh họa quá trình phản ứng của nhôm (Al) và sắt (Fe) với axit clohidric (HCl), tạo ra các sản phẩm muối clorua và khí hidro.
Kết luận: Thể tích dung dịch HCl 2M tối thiểu cần dùng để hòa tan hết 12 gam hỗn hợp X là 312.5 ml. Đáp án A là đáp án chính xác.
Hình ảnh trình bày chi tiết cách giải bài toán hóa học về phản ứng của hỗn hợp nhôm (Al) và sắt (Fe) với axit clohidric (HCl), bao gồm các bước tính toán số mol và phương trình phản ứng.
Lưu ý khi giải bài tập tương tự:
- Xác định rõ thứ tự phản ứng nếu có nhiều kim loại phản ứng với axit.
- Kiểm tra xem kim loại nào còn dư sau phản ứng.
- Sử dụng các định luật bảo toàn (khối lượng, nguyên tố) để giải bài toán.
- Chú ý đến đơn vị của các đại lượng.
Hy vọng bài viết này giúp bạn hiểu rõ hơn về dạng bài tập phản ứng của hỗn hợp kim loại với axit và có thể áp dụng để giải các bài tập tương tự.
