Khi cho kim loại kẽm (Zn) tác dụng với axit clohydric (HCl) dư, phản ứng hóa học xảy ra tạo thành muối kẽm clorua (ZnCl₂) và khí hidro (H₂). Việc tính toán khối lượng muối thu được là một bài toán hóa học cơ bản, thường gặp trong chương trình THPT. Bài viết này sẽ cung cấp kiến thức đầy đủ và chi tiết về cách giải bài toán này, giúp bạn nắm vững các công thức và phương pháp liên quan.
Phản ứng hóa học xảy ra như sau:
Zn + 2HCl → ZnCl₂ + H₂
Trong đó:
- Zn là kim loại kẽm
- HCl là axit clohydric
- ZnCl₂ là muối kẽm clorua
- H₂ là khí hidro
Để tính khối lượng muối ZnCl₂ thu được, ta cần thực hiện các bước sau:
Bước 1: Xác định số mol của ZnCl₂
Theo phương trình phản ứng, 1 mol Zn tạo ra 1 mol ZnCl₂. Vì vậy, nếu có 0,1 mol Zn phản ứng, ta sẽ thu được 0,1 mol ZnCl₂.
Bước 2: Tính khối lượng mol của ZnCl₂
Khối lượng mol của ZnCl₂ được tính bằng cách cộng khối lượng mol của các nguyên tố tạo thành nó:
M(ZnCl₂) = M(Zn) + 2 * M(Cl)
Trong đó:
- M(Zn) = 65,38 g/mol (khối lượng mol của kẽm)
- M(Cl) = 35,45 g/mol (khối lượng mol của clo)
Vậy, M(ZnCl₂) = 65,38 + 2 * 35,45 = 136,28 g/mol
Bước 3: Tính khối lượng ZnCl₂ thu được
Khối lượng ZnCl₂ thu được được tính bằng công thức:
m(ZnCl₂) = n(ZnCl₂) * M(ZnCl₂)
Trong đó:
- n(ZnCl₂) = 0,1 mol (số mol ZnCl₂)
- M(ZnCl₂) = 136,28 g/mol (khối lượng mol ZnCl₂)
Vậy, m(ZnCl₂) = 0,1 * 136,28 = 13,628 g
Vậy, khi cho 0,1 mol kim loại kẽm vào dung dịch HCl dư, khối lượng muối ZnCl₂ thu được là 13,628 gam.
Lưu ý quan trọng:
- Phản ứng xảy ra hoàn toàn do HCl dư.
- Cần nắm vững cách tính khối lượng mol của các chất.
- Việc cân bằng phương trình hóa học là rất quan trọng để xác định đúng tỉ lệ mol giữa các chất phản ứng và sản phẩm.
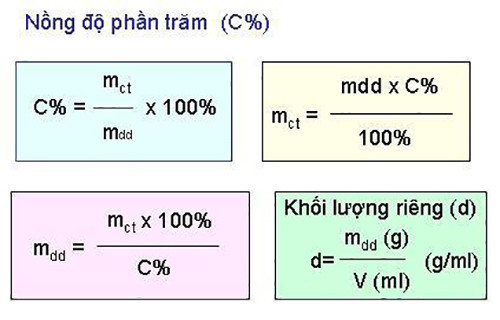
Ngoài ra, để hiểu rõ hơn về các khái niệm liên quan đến nồng độ dung dịch, bạn có thể tham khảo thêm thông tin về công thức tính nồng độ phần trăm và nồng độ mol.
Công thức tính nồng độ phần trăm:
C% = (mct / mdd) x 100%
Trong đó:
- C% là nồng độ phần trăm
- mct là khối lượng chất tan
- mdd là khối lượng dung dịch
Công thức tính nồng độ mol:
CM = n / V
Trong đó:
- CM là nồng độ mol (mol/lít)
- n là số mol chất tan
- V là thể tích dung dịch (lít)
Việc nắm vững các công thức và phương pháp tính toán này sẽ giúp bạn giải quyết các bài toán hóa học một cách dễ dàng và chính xác.