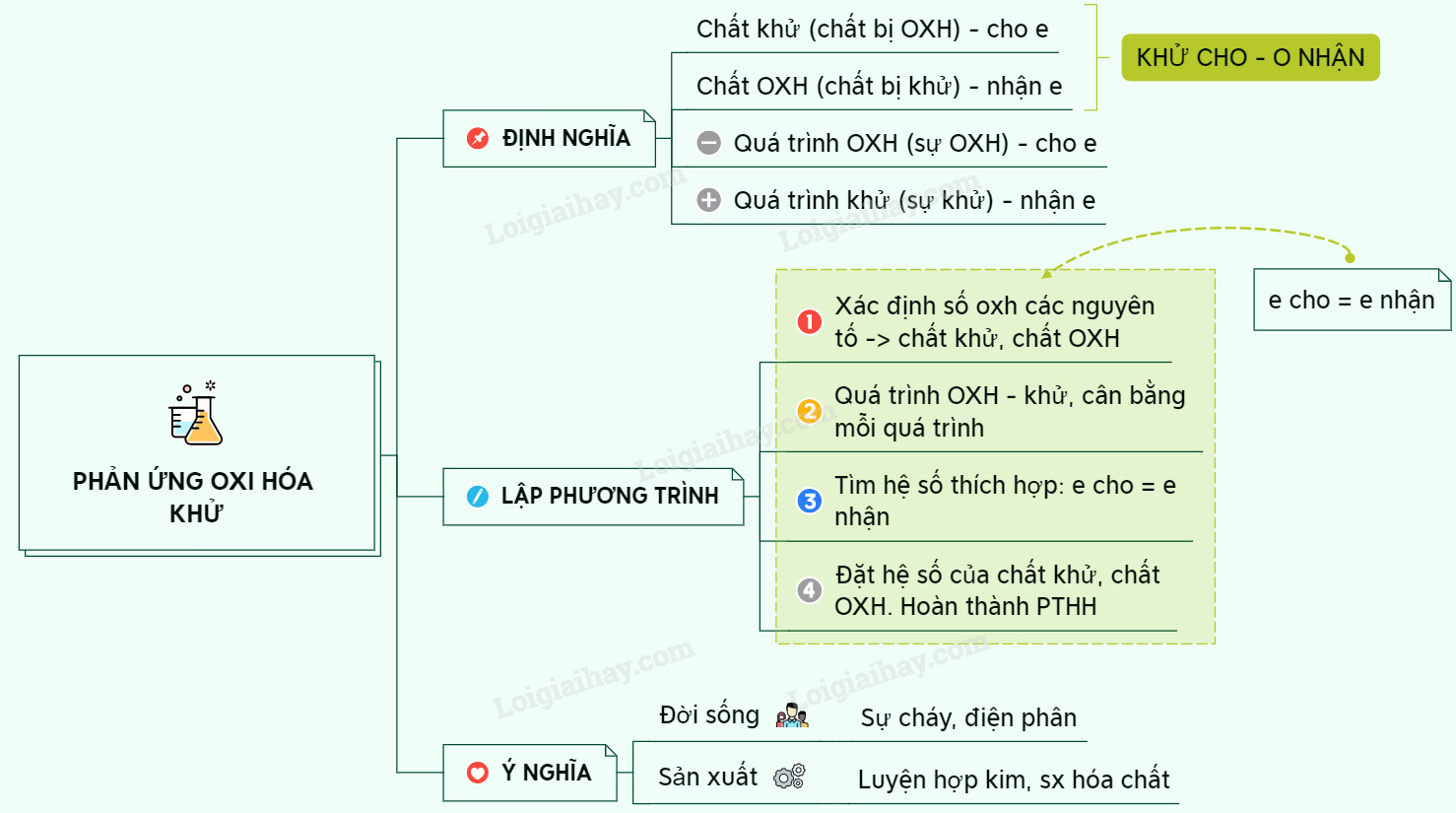
Phản ứng oxi hóa khử là một phần quan trọng trong hóa học, và để hiểu rõ về chúng, việc nắm vững khái niệm về chất khử là điều cần thiết. Vậy, Chất Khử Là Chất Có Số Oxi Hóa Tăng Hay Giảm? Câu trả lời là tăng. Bài viết này sẽ đi sâu vào định nghĩa, vai trò và cách xác định chất khử trong các phản ứng hóa học.
Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Điều này đồng nghĩa với việc có sự chuyển electron giữa các chất tham gia phản ứng.
Chất Khử và Vai Trò của Nó
Chất khử là chất nhường electron cho chất khác trong phản ứng, dẫn đến việc số oxi hóa của nó tăng lên sau phản ứng. Quá trình này được gọi là sự oxi hóa. Để dễ nhớ, ta có thể áp dụng quy tắc: “Chất khử cho tăng”.
Ngược lại, chất oxi hóa là chất nhận electron từ chất khác, làm cho số oxi hóa của nó giảm xuống sau phản ứng. Quá trình này gọi là sự khử.
Sự Oxi Hóa và Sự Khử: Hai Quá Trình Song Hành
Sự nhường electron (oxi hóa) không thể xảy ra nếu không có sự nhận electron (khử). Vì vậy, sự oxi hóa và sự khử luôn diễn ra đồng thời trong một phản ứng. Chất khử tạo nên sự oxi hóa, và chất oxi hóa tạo nên sự khử.
Xác Định Số Oxi Hóa và Chất Khử Trong Phản Ứng
Để xác định chất khử trong một phản ứng, chúng ta cần thực hiện các bước sau:
- Xác định số oxi hóa của các nguyên tố trước và sau phản ứng: Chú ý ghi số oxi hóa ở phía trên ký hiệu nguyên tố, với dấu trước, số sau.
- Xác định nguyên tố nào có số oxi hóa tăng lên: Nguyên tố này thuộc về chất khử.
- Xác định nguyên tố nào có số oxi hóa giảm xuống: Nguyên tố này thuộc về chất oxi hóa.
Ví dụ:
Xét phản ứng:
(F{{e}_{2}}{{O}_{3}},,,+{{H}_{2}},,,xrightarrow{{{t}^{o}}},,,Fe,,,+,,,{{H}_{2}}O)
Xác định số oxi hóa:
(overset{+3}{mathop{F{{e}_{2}}}},{{O}_{3}},,,+,,,overset{0}{mathop{{{H}_{2}}}},,,,xrightarrow{{{t}^{o}}},,,overset{0}{mathop{Fe}},,,,+,,,{{overset{+1}{mathop{H}},}_{2}}O)
Trong phản ứng này:
- Sắt (Fe) trong (F{{e}_{2}}{{O}_{3}}) có số oxi hóa +3, sau phản ứng giảm xuống 0 (trong Fe). Vậy (F{{e}_{2}}{{O}_{3}}) là chất oxi hóa.
- Hydro (H) trong ({{H}_{2}}) có số oxi hóa 0, sau phản ứng tăng lên +1 (trong ({{H}_{2}}O)). Vậy ({{H}_{2}}) là chất khử.
Lập Phương Trình Phản Ứng Oxi Hóa – Khử
Để lập phương trình phản ứng oxi hóa – khử, ta có thể sử dụng phương pháp thăng bằng electron theo các bước sau:
- Ghi số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
- Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
- Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
Ví dụ (tiếp tục từ ví dụ trên):
- Quá trình khử: (overset{+3}{mathop{F{{e}_{2}}}},{{O}_{3}},,,+,,,2.3e,,,to ,,,2overset{0}{mathop{Fe}},)
- Quá trình oxi hóa: (overset{0}{mathop{{{H}_{2}}}},,,,,,,to ,,,overset{+1}{mathop{{{H}_{2}}O}},,,,+2.1e)
Tìm hệ số:
- 1 (overset{+3}{mathop{F{{e}_{2}}}},{{O}_{3}},,,+,,,2.3e,,,to ,,,2overset{0}{mathop{Fe}},)
- 3 (overset{0}{mathop{{{H}_{2}}}},,,,,,,to ,,,overset{+1}{mathop{{{H}_{2}}O}},,,,+2.1e)
Kết quả: (Fe2O3 + 3H2 → 2Fe + 3H2O)
Tóm lại, chất khử là chất có số oxi hóa tăng sau phản ứng, do nhường electron cho chất khác. Việc nắm vững khái niệm này là rất quan trọng để hiểu và giải quyết các bài tập liên quan đến phản ứng oxi hóa – khử.