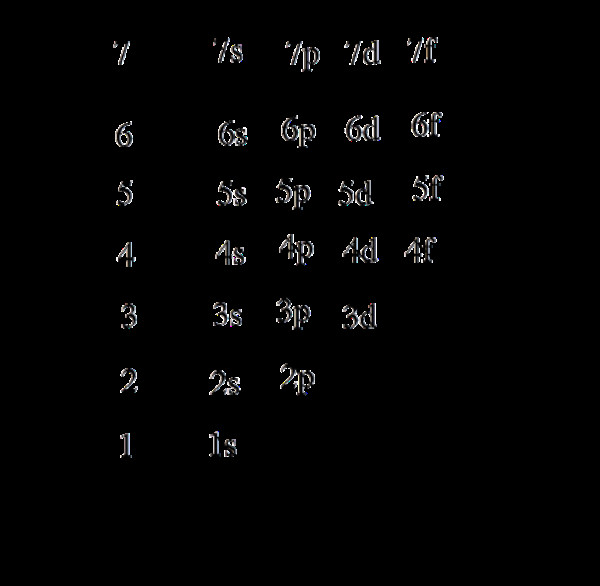1. Thứ Tự Các Mức Năng Lượng Trong Nguyên Tử
Trong trạng thái cơ bản, electron (e) của nguyên tử chiếm các mức năng lượng từ thấp đến cao. Theo thứ tự từ trong ra ngoài, mức năng lượng tại các lớp tăng từ 1 đến 7, và năng lượng của phân lớp tăng theo thứ tự s, p, d, f.
Thứ tự sắp xếp các phân lớp theo chiều tăng năng lượng là: 1s 2s 2p 3s 3p 4s 3d 4p 5s… Khi điện tích hạt nhân tăng, hiện tượng chèn ép mức năng lượng xảy ra, khiến mức năng lượng 4s thấp hơn 3d.
2. Cấu Hình Electron Nguyên Tử: Khái Niệm và Cách Viết
Cấu hình electron nguyên tử mô tả sự phân bố electron trên các phân lớp thuộc các lớp khác nhau. Đây là một công cụ quan trọng để hiểu tính chất hóa học của nguyên tố.
Để viết cấu hình electron, ta thực hiện các bước sau:
- Xác định số electron của nguyên tử: Số electron bằng số proton, và bằng số hiệu nguyên tử (Z).
- Phân bố electron theo thứ tự tăng dần mức năng lượng: Tuân theo nguyên lý Pauli, nguyên lý vững bền, và quy tắc Hund. Thứ tự lấp đầy orbital là: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s,…
- Viết cấu hình electron: Sắp xếp các phân lớp theo thứ tự lớp, ví dụ: 1s², 2s², 2p⁶, 3s¹, …
Lưu ý: Dù electron được phân bố theo thứ tự năng lượng tăng dần (có sự chèn mức năng lượng), khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Ví dụ: Nguyên tử Natri (Na) có Z = 11.
- Có 11 electron.
- Phân bố electron: 1s² 2s² 2p⁶ 3s¹
Hoặc viết gọn: [Ne] 3s¹ ([Ne] là cấu hình electron của Neon, khí hiếm).
2.1. Cấu Hình Electron Biểu Diễn Điều Gì?
Cấu hình electron cho biết sự phân bố các electron ở các phân lớp thuộc các lớp khác nhau trong nguyên tử. Điều này quyết định tính chất hóa học của nguyên tố.
2.2. Cách Viết Cấu Hình Electron Chi Tiết
2.2.1. Quy Ước Viết Cấu Hình Electron
- Số thứ tự lớp electron: 1, 2, 3,…
- Kí hiệu phân lớp: s, p, d, f
- Số electron trong phân lớp: ghi ở phía trên, bên phải kí hiệu phân lớp (ví dụ: s², p⁶, d¹⁰).
2.2.2. Nguyên Tắc và Quy Tắc Cần Tuân Thủ
Để viết cấu hình electron chính xác, cần nắm vững:
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa 2 electron có spin đối nhau.
- Quy tắc Hund: Trong cùng một phân lớp, các electron phân bố sao cho số electron độc thân (chưa ghép đôi) là tối đa và có spin giống nhau.
- Nguyên lý vững bền: Electron chiếm các orbital có mức năng lượng từ thấp đến cao.
2.2.3. Các Bước Viết Cấu Hình Electron Chi Tiết
Bước 1: Xác định số electron trong nguyên tử (Z).
Bước 2: Phân bố electron vào các phân lớp theo thứ tự năng lượng tăng dần: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,… Cần nhớ số electron tối đa mỗi phân lớp chứa:
- s: 2 electron
- p: 6 electron
- d: 10 electron
- f: 14 electron
Bước 3: Viết cấu hình electron hoàn chỉnh bằng cách liệt kê các phân lớp và số electron trên mỗi phân lớp.
2.2.4. Xác Định Nguyên Tố s, p, d, f
Dựa vào cấu hình electron vừa viết được, ta có thể xác định nguyên tố đó thuộc loại nào:
- Nguyên tố s: Electron cuối cùng điền vào phân lớp s.
- Nguyên tố p: Electron cuối cùng điền vào phân lớp p.
- Nguyên tố d: Electron cuối cùng điền vào phân lớp d.
- Nguyên tố f: Electron cuối cùng điền vào phân lớp f.
Lưu ý các trường hợp đặc biệt: Một số nguyên tố có cấu hình electron bán bão hòa hoặc bão hòa bền vững hơn, ví dụ:
- Cr (Z = 24): Thay vì 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁴ 4s², cấu hình đúng là 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵ 4s¹.
- Cu (Z = 29): Thay vì 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁹ 4s², cấu hình đúng là 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s¹.
3. Đặc Điểm Lớp Electron Ngoài Cùng
Lớp electron ngoài cùng (lớp valence) đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố.
- Tối đa 8 electron: Gần như tất cả các nguyên tố đều có tối đa 8 electron ở lớp ngoài cùng.
- Khí hiếm: Các nguyên tố có 8 electron ở lớp ngoài cùng (cấu hình ns² np⁶) là các khí hiếm, rất bền vững và ít tham gia phản ứng hóa học.
- Kim loại: Các nguyên tử có 1, 2, hoặc 3 electron ở lớp ngoài cùng thường là kim loại, dễ nhường electron.
- Phi kim: Các nguyên tử có 5, 6, hoặc 7 electron ở lớp ngoài cùng thường là phi kim, dễ nhận electron.
- Bán kim: Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là kim loại hoặc phi kim.
4. Bảng Cấu Hình Electron của 20 Nguyên Tố Đầu Tiên
Bảng dưới đây liệt kê cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn, giúp bạn dễ dàng hình dung cách viết cấu hình electron:
5. Sơ Đồ Tư Duy Cấu Hình Electron
Sơ đồ tư duy là một công cụ hữu ích để hệ thống hóa kiến thức về cấu hình electron.
6. Bài Tập Vận Dụng
6.1. Bài Tập Cơ Bản và Nâng Cao
Ví dụ 1: Một nguyên tử của nguyên tố X có 3 lớp electron và 4 electron ở lớp ngoài cùng. Xác định số hiệu nguyên tử và viết cấu hình electron của X.
Giải:
- Z = 2 + 8 + 4 = 14
- Cấu hình electron của X: 1s² 2s² 2p⁶ 3s² 3p²
Ví dụ 2: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tính tổng số electron s và electron p của nguyên tố d.
Giải:
- Nguyên tố d có 4 lớp electron, electron cuối cùng thuộc phân lớp 3d.
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s²
- Tổng số electron s và p: 2 + 2 + 6 + 2 + 6 = 20
Ví dụ 3: Nguyên tử X có ký hiệu là X₂₆⁵⁶. Viết cấu hình electron và xác định X là kim loại hay phi kim.
Giải:
- Phân bố electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
- Cấu hình electron: [Ar] 3d⁶ 4s²
- X là kim loại vì có 2 electron ở lớp ngoài cùng.
Ví dụ 4: Số electron lớp ngoài cùng của các nguyên tố có Z = 3, 6, 9, 18 lần lượt là bao nhiêu?
Giải:
- Z = 3: 1s² 2s¹ (1 electron)
- Z = 6: 1s² 2s² 2p² (4 electron)
- Z = 9: 1s² 2s² 2p⁵ (7 electron)
- Z = 18: 1s² 2s² 2p⁶ 3s² 3p⁶ (8 electron)
Ví dụ 5: Có bao nhiêu nguyên tố có lớp ngoài cùng thuộc lớp M (n=3)?
Giải:
Có 8 nguyên tố:
1s² 2s² 2p⁶ 3s¹
1s² 2s² 2p⁶ 3s²
1s² 2s² 2p⁶ 3s² 3p¹
1s² 2s² 2p⁶ 3s² 3p²
1s² 2s² 2p⁶ 3s² 3p³
1s² 2s² 2p⁶ 3s² 3p⁴
1s² 2s² 2p⁶ 3s² 3p⁵
1s² 2s² 2p⁶ 3s² 3p⁶
6.2. Bài Tập Trắc Nghiệm
(Các câu hỏi trắc nghiệm và đáp án đã được cung cấp trong bài viết gốc, bạn có thể tham khảo để luyện tập thêm.)
Hy vọng bài viết này đã cung cấp cho bạn đầy đủ kiến thức về Cách Viết Cấu Hình Electron Nguyên Tử. Chúc bạn học tốt!