Trong hóa học, việc phân biệt phản ứng thu nhiệt và tỏa nhiệt là vô cùng quan trọng. Bài viết này sẽ cung cấp cho bạn những kiến thức chi tiết và dễ hiểu nhất để nhận biết hai loại phản ứng này, giúp bạn tự tin chinh phục môn Hóa học.
Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là các phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc âm thanh ra môi trường xung quanh. Đặc điểm nổi bật của loại phản ứng này là nhiệt độ của môi trường xung quanh tăng lên.
Phản ứng tỏa nhiệt thường xảy ra tự phát và làm tăng tính ngẫu nhiên (entropy) của hệ thống (S > 0). Về mặt nhiệt động học, phản ứng tỏa nhiệt được biểu thị bằng biến thiên enthalpy (ΔH) âm, cho thấy hệ thống mất nhiệt vào môi trường.
Ảnh minh họa quá trình tỏa nhiệt, nhiệt lượng từ hệ thống phản ứng tỏa ra môi trường, thể hiện bằng mũi tên đỏ.
Ví dụ về phản ứng tỏa nhiệt:
-
Phản ứng đốt cháy: Đốt củi, đốt gas, đốt than đều là các phản ứng tỏa nhiệt mạnh, sinh ra nhiệt và ánh sáng.
C + O₂ → CO₂ (Phản ứng tỏa nhiệt lớn, dùng để nấu chín thức ăn và sưởi ấm)
-
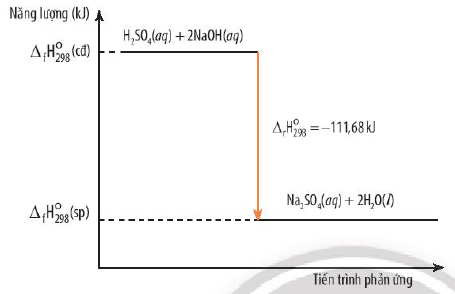
Phản ứng trung hòa axit-bazơ: Khi trộn axit mạnh với bazơ mạnh, nhiệt sẽ được giải phóng.
H₂SO₄ (aq) + 2NaOH (aq) → Na₂SO₄ (aq) + 2 H₂O (l) (ΔH°₂₉₈ = -111.68 kJ)
-
Phản ứng nhiệt nhôm: Phản ứng giữa nhôm và oxit sắt (III) tỏa ra lượng nhiệt lớn, đủ để làm nóng chảy sắt.
2Al + Fe₂O₃ → Al₂O₃ + 2Fe (Phản ứng tỏa nhiệt mạnh, ứng dụng trong hàn đường ray)
Phản Ứng Thu Nhiệt Là Gì?
Trái ngược với phản ứng tỏa nhiệt, phản ứng thu nhiệt là quá trình hấp thụ năng lượng từ môi trường xung quanh dưới dạng nhiệt. Kết quả là nhiệt độ của môi trường xung quanh giảm xuống. Phản ứng thu nhiệt không thể tự xảy ra mà cần cung cấp năng lượng liên tục.
Trong phản ứng thu nhiệt, năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng lớn hơn năng lượng giải phóng khi hình thành liên kết mới trong sản phẩm. Điều này dẫn đến biến thiên enthalpy (ΔH) dương và phản ứng không tự phát.
Ảnh minh họa quá trình thu nhiệt, nhiệt lượng từ môi trường hấp thụ vào hệ thống phản ứng, thể hiện bằng mũi tên xanh.
Ví dụ về phản ứng thu nhiệt:
-
Phản ứng phân hủy: Nung đá vôi (CaCO₃) cần cung cấp nhiệt liên tục để tạo ra vôi sống (CaO) và khí CO₂.
CaCO₃ (s) → CaO (s) + CO₂ (g) (Nếu ngừng cung cấp nhiệt, phản ứng sẽ dừng lại)
-
Phản ứng hòa tan một số muối: Hòa tan amoni clorua (NH₄Cl) trong nước làm lạnh cốc do dung dịch hấp thụ nhiệt từ môi trường.
-
Quang hợp: Cây xanh hấp thụ ánh sáng mặt trời (năng lượng) để tổng hợp chất hữu cơ từ CO₂ và nước.
-
Điện phân nước: Cần cung cấp điện năng (năng lượng) để phân tách nước thành khí hydro và khí oxy.
Biến Thiên Enthalpy Chuẩn (ΔH°₂₉₈)
Biến thiên enthalpy chuẩn (ΔH°₂₉₈) là lượng nhiệt tỏa ra hoặc thu vào của một phản ứng hóa học ở điều kiện chuẩn (25°C và 1 bar). Đơn vị thường dùng là kJ/mol hoặc kcal/mol.
- ΔH°₂₉₈ < 0: Phản ứng tỏa nhiệt (giải phóng năng lượng).
- ΔH°₂₉₈ > 0: Phản ứng thu nhiệt (hấp thụ năng lượng).
Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình phản ứng hóa học, trong đó ghi rõ trạng thái của các chất (rắn (s), lỏng (l), khí (g), dung dịch (aq)) và kèm theo giá trị biến thiên enthalpy (ΔH).
Ví dụ:
- C(s) + H₂O(g) → CO(g) + H₂(g) ΔH°₂₉₈ = +131.25 kJ (Phản ứng thu nhiệt)
- CuSO₄(aq) + Zn(s) → ZnSO₄(aq) + Cu(s) ΔH°₂₉₈ = -231.04 kJ (Phản ứng tỏa nhiệt)
Bảng So Sánh Phản Ứng Thu Nhiệt và Tỏa Nhiệt
| Đặc điểm | Phản ứng tỏa nhiệt | Phản ứng thu nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng ra môi trường | Hấp thụ năng lượng từ môi trường |
| Biến thiên enthalpy (ΔH) | ΔH < 0 (âm) | ΔH > 0 (dương) |
| Nhiệt độ môi trường | Tăng | Giảm |
| Tính tự phát | Thường xảy ra tự phát | Cần cung cấp năng lượng để xảy ra |
| Ví dụ | Đốt cháy, trung hòa axit-bazơ | Phân hủy, hòa tan một số muối, quang hợp |

Cách Nhận Biết Phản Ứng Thu Nhiệt Hay Tỏa Nhiệt Trong Thực Tế
- Theo dõi nhiệt độ: Nếu nhiệt độ của hệ phản ứng tăng lên, đó là phản ứng tỏa nhiệt. Nếu nhiệt độ giảm xuống, đó là phản ứng thu nhiệt.
- Xem xét phương trình nhiệt hóa học: Nếu ΔH < 0, phản ứng tỏa nhiệt; nếu ΔH > 0, phản ứng thu nhiệt.
- Quan sát dấu hiệu: Một số phản ứng tỏa nhiệt có thể kèm theo các dấu hiệu như phát sáng, nổ.
- Nghiên cứu điều kiện phản ứng: Các phản ứng cần cung cấp nhiệt liên tục thường là phản ứng thu nhiệt.
Nắm vững kiến thức về phản ứng thu nhiệt và tỏa nhiệt sẽ giúp bạn hiểu rõ hơn về các quá trình hóa học diễn ra xung quanh chúng ta. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và dễ hiểu nhất. Chúc bạn học tốt!
