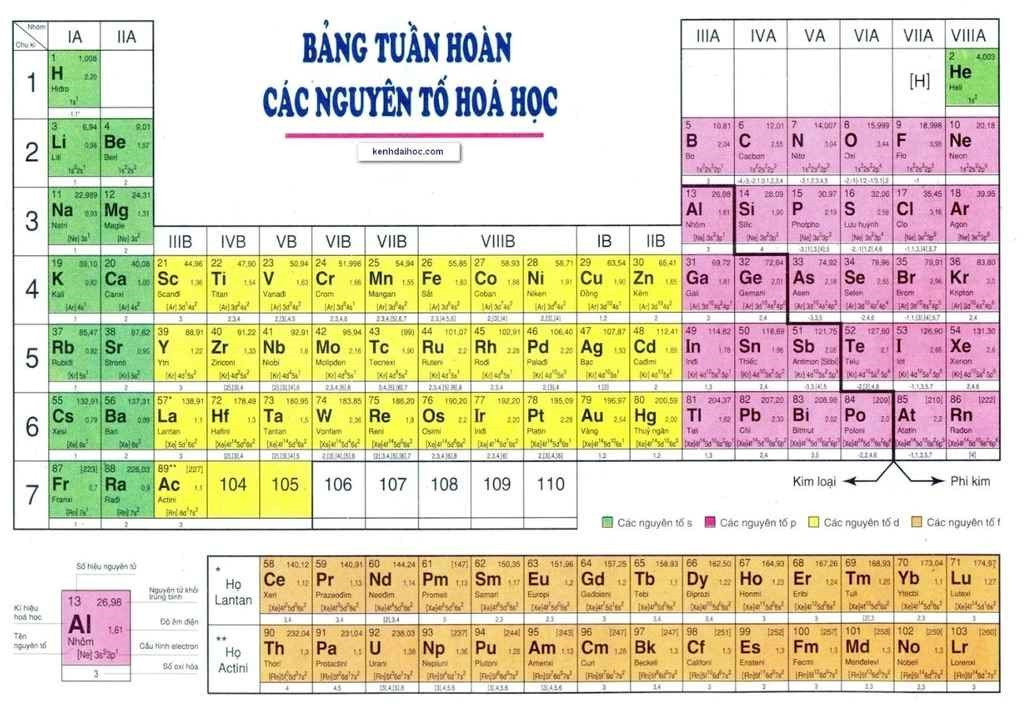
Bảng tuần hoàn các nguyên tố hóa học là một công cụ vô cùng quan trọng trong hóa học, đặc biệt đối với các em học sinh lớp 7. Nó không chỉ là một bảng liệt kê đơn thuần, mà còn là một “bản đồ” giúp chúng ta hiểu rõ hơn về cấu tạo và tính chất của các nguyên tố tạo nên thế giới xung quanh.
I. Nguyên Tắc Sắp Xếp Các Nguyên Tố Trong Bảng Tuần Hoàn
Bảng tuần hoàn hiện đại được xây dựng dựa trên nguyên tắc sắp xếp các nguyên tố theo chiều tăng dần của điện tích hạt nhân (số proton). Các nguyên tố có cùng số lớp electron được xếp vào cùng một hàng (chu kỳ), và các nguyên tố có tính chất hóa học tương tự nhau được xếp vào cùng một cột (nhóm).
Bảng tuần hoàn hiện đại với cách sắp xếp khoa học, giúp dễ dàng tra cứu thông tin và dự đoán tính chất của các nguyên tố.
II. Cấu Tạo Của Bảng Tuần Hoàn
Bảng tuần hoàn gồm các thành phần chính sau:
1. Ô Nguyên Tố:
Mỗi ô nguyên tố chứa đựng thông tin cơ bản về một nguyên tố, bao gồm:
- Số hiệu nguyên tử (Z): Số proton trong hạt nhân, đồng thời là số thứ tự của nguyên tố trong bảng tuần hoàn.
- Kí hiệu hóa học: Chữ viết tắt của tên nguyên tố (ví dụ: H cho Hydrogen, O cho Oxygen).
- Tên nguyên tố: Tên gọi của nguyên tố đó.
- Khối lượng nguyên tử: Khối lượng trung bình của một nguyên tử của nguyên tố đó.
Ô nguyên tố Carbon cung cấp thông tin quan trọng: số hiệu nguyên tử (6), ký hiệu hóa học (C), tên nguyên tố (Carbon), và khối lượng nguyên tử.
2. Chu Kì:
Chu kì là hàng ngang trong bảng tuần hoàn. Các nguyên tố trong cùng một chu kì có cùng số lớp electron trong nguyên tử. Bảng tuần hoàn hiện nay có 7 chu kì, được đánh số từ 1 đến 7.
Chu kỳ 2 bao gồm các nguyên tố Li, Be, B, C, N, O, F, và Ne, tất cả đều có 2 lớp electron.
3. Nhóm:
Nhóm là cột dọc trong bảng tuần hoàn. Các nguyên tố trong cùng một nhóm thường có tính chất hóa học tương tự nhau do có số electron lớp ngoài cùng giống nhau. Bảng tuần hoàn gồm 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB).
Nhóm IA (ví dụ: Na, K) là các kim loại kiềm hoạt động mạnh, trong khi nhóm VIIA (ví dụ: Cl, Br) là các halogen có tính oxi hóa cao.
III. Vị Trí Của Kim Loại, Phi Kim và Khí Hiếm
Bảng tuần hoàn giúp chúng ta dễ dàng xác định vị trí của các nguyên tố kim loại, phi kim và khí hiếm:
- Kim loại: Chiếm phần lớn trong bảng tuần hoàn, thường nằm ở nhóm IA, IIA, IIIA và nhóm B.
- Phi kim: Thường nằm ở nhóm VA, VIA, VIIA và một số ít ở nhóm IIIA, IVA.
- Khí hiếm: Nằm ở nhóm VIIIA, có tính trơ hóa học cao.
Kim loại có vai trò quan trọng trong xây dựng, sản xuất và nhiều ngành công nghiệp khác.
Phi kim đóng vai trò thiết yếu trong nhiều hợp chất hóa học và quá trình sinh học.
Khí hiếm có tính chất đặc biệt, được ứng dụng rộng rãi trong các lĩnh vực công nghệ cao.
Kết luận:
Bảng tuần hoàn các nguyên tố hóa học là một công cụ vô giá cho việc học tập và nghiên cứu hóa học. Việc nắm vững cấu trúc và nguyên tắc sắp xếp của bảng tuần hoàn sẽ giúp các em học sinh lớp 7 dễ dàng tiếp cận và hiểu sâu hơn về thế giới hóa học đầy thú vị.