Axit clohidric là một hóa chất quan trọng và được sử dụng rộng rãi trong nhiều ngành công nghiệp và đời sống. Bài viết này sẽ cung cấp thông tin chi tiết về axit clohidric, đặc biệt tập trung vào “Axit Clohidric Ký Hiệu” (HCl), tính chất, ứng dụng và các lưu ý an toàn khi sử dụng.
1. Axit Clohidric Là Gì?
Axit clohidric, với ký hiệu hóa học là HCl, là một hợp chất vô cơ có tính axit mạnh. Nó tồn tại ở dạng khí không màu hoặc dung dịch lỏng. HCl còn được biết đến với nhiều tên gọi khác như axit muriatic hoặc axit hydrocloric. Do tính ăn mòn cao, việc sử dụng HCl đòi hỏi sự cẩn trọng để tránh gây tổn thương cho da, mắt và hệ hô hấp.
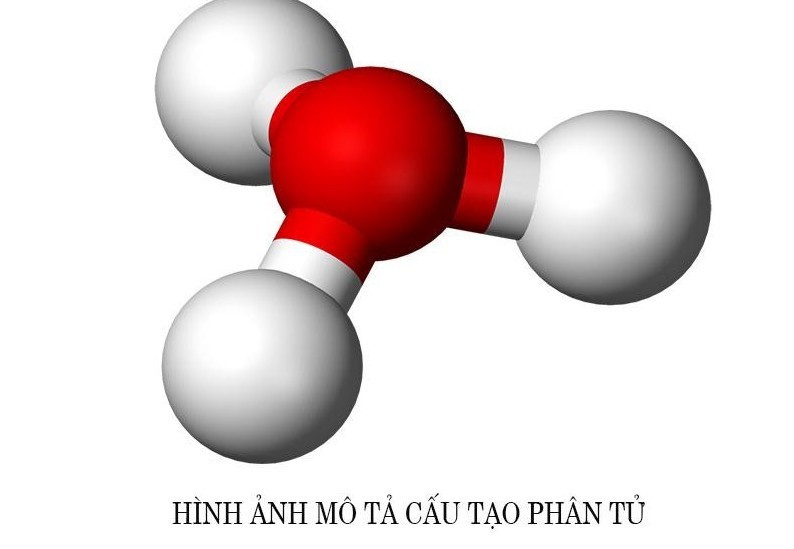
2. Cấu Tạo Phân Tử Axit Clohidric (HCl)
Cấu tạo phân tử của axit clohidric (HCl) bao gồm một nguyên tử hydro (H) liên kết với một nguyên tử clo (Cl) thông qua liên kết cộng hóa trị.
3. Tính Chất Lý Hóa Đặc Trưng Của Axit Clohidric (HCl)
3.1. Tính Chất Vật Lý
- HCl dạng khí không màu, có mùi xốc đặc trưng và tan tốt trong nước, tạo thành dung dịch axit mạnh.
- HCl nặng hơn không khí.
- Dung dịch HCl loãng không màu, trong khi dung dịch đậm đặc (nồng độ tối đa 40%) có màu vàng ngả xanh.
- Dung dịch HCl đậm đặc có thể tạo thành sương mù axit trong không khí.
- Độ hòa tan trong nước cao: 725 g/L ở 20°C.
- Trọng lượng phân tử: 36,5 g/mol.
- Dung dịch HCl không dễ cháy nhưng dễ bay hơi.
3.2. Tính Chất Hóa Học
Axit clohidric (HCl) là một axit mạnh, thể hiện đầy đủ các tính chất hóa học đặc trưng của axit:
-
Đổi màu chất chỉ thị: Làm quỳ tím chuyển sang màu đỏ.
-
Tác dụng với bazơ: Tạo thành muối và nước.
Ví dụ:
Cu(OH)2 + 2HCl → CuCl2 + 2H2OAl(OH)3 + 3HCl → AlCl3 + 3H2O -
Tác dụng với oxit kim loại: Tạo thành muối và nước, kim loại giữ nguyên hóa trị.
Ví dụ:
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3CuO + 2HCl → CuCl2 + H2O -
Tác dụng với kim loại (đứng trước H trong dãy hoạt động hóa học, trừ Pb): Tạo thành muối và giải phóng khí hydro.
Ví dụ:
Fe + 2HCl → FeCl2 + H2 -
Tác dụng với muối: Tạo thành muối mới và axit mới.
Ví dụ:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2AgNO3 + HCl → AgCl + HNO3 -
Tác dụng với chất oxi hóa mạnh: Ví dụ KMnO4, K2Cr2O7, MnO2, KClO3.
Ví dụ:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4. Điều Chế và Sản Xuất Axit Clohidric (HCl)
4.1. Điều Chế Trong Phòng Thí Nghiệm
HCl có thể được điều chế bằng phương pháp sunfat, tạo ra dung dịch có nồng độ lên đến 40%:
NaCl (rắn) + H2SO4 (đặc) → NaHSO4 + HCl
Ở nhiệt độ cao hơn (>400°C):
2NaCl (rắn) + H2SO4 (đặc) → Na2SO4 + 2HCl
4.2. Sản Xuất Trong Công Nghiệp
Trong công nghiệp, axit clohidric (HCl) thường được sản xuất với nồng độ 32-34% bằng phương pháp tổng hợp trực tiếp từ clo và hydro:
H2 + Cl2 → 2HCl (đun nóng)
5. Ứng Dụng Quan Trọng Của Axit Clohidric (HCl)
Axit clohidric (ký hiệu HCl) có rất nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau:
-
Tẩy gỉ thép: Dung dịch HCl 18% thường được sử dụng để loại bỏ gỉ sét trên bề mặt thép.
Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O -
Sản xuất hợp chất hữu cơ: HCl được sử dụng để sản xuất các hợp chất hữu cơ như vinyl clorua (sản xuất PVC) và dicloroetan.
2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O -
Sản xuất than hoạt tính:
gỗ + HCl + nhiệt → than hoạt tính -
Sản xuất hợp chất vô cơ: HCl tham gia vào các phản ứng axit-bazơ để tạo ra nhiều hợp chất vô cơ khác.
-
Kiểm soát và trung hòa pH: HCl được sử dụng để điều chỉnh độ pH trong các dung dịch, đặc biệt là giảm tính bazơ.
OH− + HCl → H2O + Cl− -
Tái sinh nhựa trao đổi ion: HCl được dùng để rửa các cation khỏi nhựa trao đổi ion trong quá trình khử khoáng nước.
-
Ứng dụng trong nhiều ngành công nghiệp: Bao gồm công nghiệp hóa chất, sản xuất nước uống và một số ngành công nghiệp thực phẩm.
-
Sản xuất thực phẩm: HCl được sử dụng trong sản xuất aspartame, fructose, axit citric, lysine, thủy phân protein thực vật và gelatin.
-
Các ứng dụng khác: Xử lý da, vệ sinh nhà cửa, xây dựng.
Axit clohidric (HCl) được sử dụng như một chất keo tụ trong quá trình xử lý nước thải để loại bỏ các chất ô nhiễm.
6. Lưu Ý An Toàn Khi Sử Dụng Axit Clohidric (HCl)
Axit clohidric là một hóa chất nguy hiểm và cần được sử dụng cẩn thận:
- Trang bị bảo hộ: Khi làm việc với HCl, cần trang bị đầy đủ thiết bị bảo hộ như mặt nạ, găng tay, kính bảo hộ, khẩu trang chuyên dụng và quần áo bảo hộ.
- Tránh rơi vãi: Hạn chế tối đa tình trạng rơi vãi HCl. Nếu xảy ra, cần rửa sạch khu vực bị ảnh hưởng bằng nước.
- Sơ cứu: Nếu HCl bắn vào người, cần rửa ngay bằng nước sạch nhiều lần. Nếu bắn vào mắt, cần đưa nạn nhân đến cơ sở y tế để được xử lý kịp thời.
Lưu ý khi bảo quản:
- Bảo quản HCl ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và nước mưa.
- Kho chứa phải an toàn, nền kho làm bằng vật liệu chống axit để tránh nguy cơ rò rỉ.
- Không bảo quản HCl chung với các chất oxi hóa, chất dễ cháy và kim loại.
7. Mua Axit Clohidric (HCl) Ở Đâu Uy Tín?
Nếu bạn đang tìm mua axit clohidric (HCl) chất lượng, VietChem là một lựa chọn đáng tin cậy. Đây là một trong những nhà cung cấp hóa chất công nghiệp và hóa chất tinh khiết hàng đầu tại Việt Nam.
Để đặt mua hàng, bạn có thể liên hệ với VietChem qua các kênh sau:
- VPGD tại Hà Nội: Số 9 Ngõ 51, Lãng Yên, Hai Bà Trưng – Hà Nội.
- Hotline: 0826 010 010.
- Website: vietchem.com.vn.