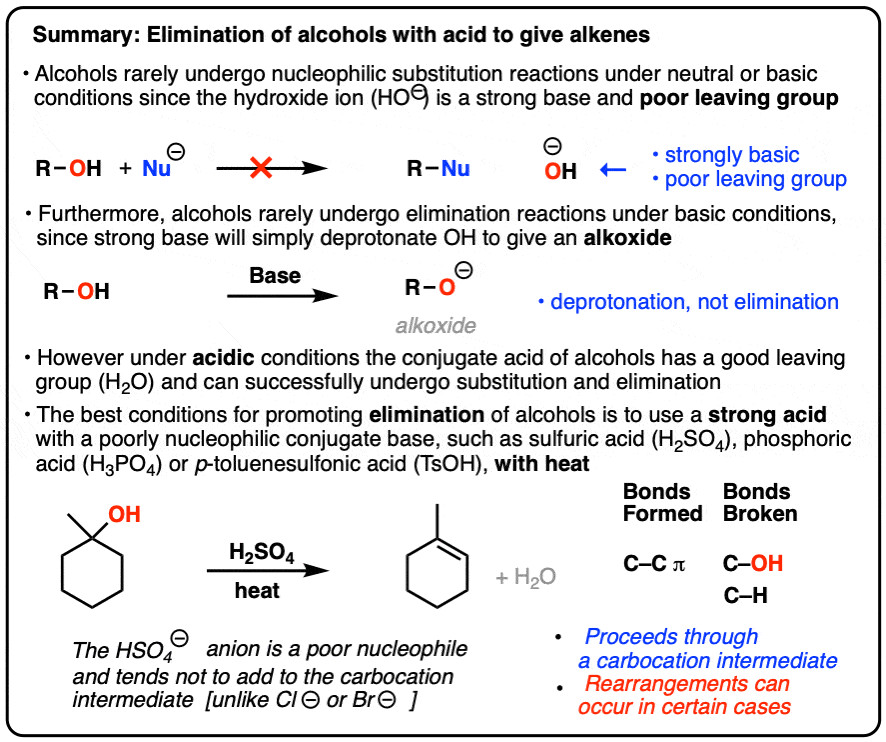
Phản ứng loại nước của alcohol là một quá trình quan trọng trong hóa học hữu cơ, đặc biệt khi sử dụng các axit mạnh như H2SO4 (axit sulfuric). Tuy nhiên, việc sử dụng HCL (axit clohydric) trong các phản ứng tương tự mang lại những kết quả khác biệt đáng kể. Bài viết này sẽ đi sâu vào cơ chế và các yếu tố ảnh hưởng đến phản ứng loại nước của alcohol, tập trung vào sự khác biệt giữa H2SO4 và HCL.
Thông thường, nhóm hydroxyl (OH) trong alcohol là một nhóm rời đi kém. Tuy nhiên, khi được xử lý với một axit mạnh, ROH chuyển thành ROH2+, và H2O trở thành một nhóm rời đi tốt hơn nhiều. Đối với các alcohol bậc ba, H2O có thể rời đi, dẫn đến sự hình thành carbocation.
Nếu một axit mạnh như H2SO4 được sử dụng, kết quả có khả năng nhất là phản ứng loại trừ (elimination), vì các bazơ liên hợp của các axit này (HSO4-) là các nucleophile kém và ít có khả năng thêm vào carbocation.
1. Axit Hydrohalic (HX) cộng với Alcohol tạo ra sản phẩm thế…
Trước đây, chúng ta đã thấy rằng việc xử lý một alcohol với một axit hydrohalic mạnh – ví dụ như HCl, HBr, hoặc HI – dẫn đến sự hình thành các halide alkyl. Với một alcohol bậc ba, quá trình này diễn ra thông qua cơ chế SN1. [Proton hóa alcohol, sau đó mất H2O để tạo thành một carbocation, sau đó tấn công của nucleophile vào carbocation].
2. …Nhưng H2SO4, H3PO4, và TsOH lại tạo ra sản phẩm loại trừ!
Bạn có thể nghĩ rằng nếu chúng ta xử lý một alcohol với H2SO4 (axit sulfuric), điều tương tự sẽ xảy ra, và carbocation sẽ bị tấn công bởi anion (-)OSO3H để tạo ra sản phẩm thế. Tuy nhiên, trong thực tế, nó không hoạt động như vậy!
Vậy điều gì đã xảy ra ở đây?
Đầu tiên, hãy nhìn vào những liên kết nào đã hình thành và bị phá vỡ. Chúng ta đã hình thành C-C (π) và phá vỡ C-OH và C-H. (Chúng ta cũng hình thành H-O, trong phân tử nước hình thành như một sản phẩm phụ). Đây là mô hình của một phản ứng loại trừ (elimination).
Bây giờ hãy hỏi: Làm thế nào điều này có thể hình thành? Nếu bạn nhìn kỹ, lưu ý rằng chúng ta đã phá vỡ một liên kết C-H trên carbon liền kề với carbocation và hình thành một liên kết C-C π mới tại vị trí đó. Hoàn toàn hợp lý khi cho rằng thay vì tấn công carbocation để tạo thành một sản phẩm thay thế mới, một bazơ đã loại bỏ một proton liền kề với carbocation và hình thành alkene. [Carbon liền kề với carbocation thường được gọi là “carbon β (beta)”. Bản thân carbocation là “carbon α (alpha)”].
3. Phản ứng loại trừ của Alcohol bậc ba diễn ra thông qua cơ chế E1
Chúng ta đã thấy loại quá trình này trước đây! Đây là một quá trình E1 [loại trừ (E), đơn phân tử (1) bước xác định tốc độ]. Bạn cũng có thể nhớ rằng các phản ứng loại trừ có xu hướng tuân theo “Quy tắc Zaitsev” – chúng ta luôn hình thành alkene được thay thế nhiều nhất [hoặc nói cách khác, chúng ta loại bỏ một proton từ carbon có ít hydro gắn liền nhất] vì độ ổn định alkene tăng lên khi chúng ta tăng số lượng carbon gắn liền.
[Nhân tiện, bạn có thể hỏi – tại sao lại “nhiệt”? Nhiệt thường có xu hướng ưu tiên các phản ứng loại trừ.]
Không chỉ có H2SO4 là axit duy nhất thực hiện điều này. Axit phosphoric (H3PO4) cũng như “axit tosic” (axit p-toluenesulfonic) cũng có xu hướng tạo thành sản phẩm loại trừ.
4. Tại sao H2SO4 (hoặc H3PO4 hoặc TsOH) tạo ra sản phẩm loại trừ nhưng HCl, HBr, HI lại tạo ra sản phẩm thế?
Vậy tại sao chúng ta lại có các phản ứng loại trừ với H2SO4 làm axit (hoặc H3PO4, hoặc TsOH) trong khi chúng ta lại có các phản ứng thế với HCl, HBr và HI?
Câu trả lời là anion HSO4– là một nucleophile rất kém, vì nó khá ổn định do cộng hưởng. Trong sơ đồ bên dưới, lưu ý cách điện tích âm được giải tỏa trên ba oxy khác nhau [điều tương tự cũng đúng với các anion TsO– và H2PO4–].
So sánh điều đó với các anion halide, nơi điện tích âm không thể lan rộng trên nhiều hơn một nguyên tử. Kết quả là việc giải tỏa điện tích dẫn đến phản ứng chậm hơn của HSO4– như một nucleophile so với sự khử proton của C-H bằng một bazơ, và sản phẩm alkene chiếm ưu thế.
Do đó, điểm mấu chốt ở đây là việc đun nóng các alcohol bậc ba với các axit này sẽ dẫn đến mất nước [“dehydration”] và sự hình thành một alkene [loại trừ].
5. Điều gì về các phản ứng loại trừ của alcohol bậc hai?
Đun nóng một alcohol bậc hai với axit sulfuric hoặc axit phosphoric? Tương tự như với alcohol bậc ba: mong đợi một alkene sẽ hình thành. Như với tất cả các phản ứng loại trừ, có hai điều cần chú ý: thứ nhất, alkene “được thay thế nhiều nhất” (Zaitsev) sẽ là sản phẩm chiếm ưu thế, và thứ hai, đừng quên rằng các alkene trans sẽ được ưu tiên hơn (ổn định hơn) so với các alkene cis do ít căng thẳng không gian hơn.
Có một điều cuối cùng cần chú ý với alcohol bậc hai… giống như một cơn ác mộng tồi tệ, chúng cứ quay trở lại.
6. Phản ứng loại trừ với sự sắp xếp lại Carbocation
Như chúng ta đã thấy với các phản ứng của HCl, HBr và HI với alcohol bậc hai, chúng ta phải chú ý đến các phản ứng sắp xếp lại carbocation. Nếu một carbocation ổn định hơn có thể được hình thành thông qua sự di chuyển của một hydride (H-) hoặc một nhóm alkyl liền kề, thì sự di chuyển đó sẽ xảy ra.
Ví dụ, việc xử lý alcohol dưới đây bằng H2SO4 dẫn đến sự hình thành một carbocation bậc hai, sau đó là một sự dịch chuyển hydride để tạo ra một carbocation bậc ba, sau đó là sự khử proton tại bất kỳ carbon β nào dẫn đến alkene được thay thế nhiều nhất.
7. Sự mở rộng vòng sau đó là loại trừ
Cũng có thể xảy ra sự dịch chuyển alkyl để tạo ra một carbocation ổn định hơn. Một ví dụ điển hình về điều này là sự mở rộng của các vòng căng (như cyclobutane) để tạo ra các vòng ít căng hơn (như cyclopentane).
Ví dụ, trong trường hợp dưới đây, bước quan trọng là nơi liên kết C3-C4 bị phá vỡ để hình thành liên kết C2-C4, dẫn đến một carbocation (bậc ba) mới trên C-3 cũng như một vòng ít căng hơn. Vì không có một nucleophile tốt xung quanh, nên sự loại trừ xảy ra theo cách mà alkene được thay thế nhiều nhất được hình thành.
8. Alcohol bậc một và H2SO4 có thể tạo thành Alkene (E2)
Lớp alcohol cuối cùng cần quan tâm là alcohol bậc một. Bạn có thể hỏi: nếu chúng ta xử lý một alcohol bậc một (ví dụ: 1-butanol) bằng một axit mạnh như H2SO4, liệu chúng ta cũng sẽ loại trừ để tạo ra một alkene?
Có, alkene có thể được hình thành theo cách này (cùng với một số sự hình thành ether đối xứng xem bài đăng trước đó này]). Đây là một ví dụ.
Tuy nhiên, có một lưu ý: con đường E1 (sự hình thành một carbocation bậc một) không phải là con đường có khả năng nhất ở đây. Carbocation bậc một có xu hướng cực kỳ không ổn định, và có nhiều khả năng phản ứng đi qua một cơ chế E2, nơi trạng thái chuyển tiếp sẽ có năng lượng thấp hơn. Lưu ý những gì xảy ra ở đây: đầu tiên chúng ta proton hóa alcohol để tạo ra nhóm rời đi tốt OH2+, và sau đó một bazơ yếu (mà tôi đang để mơ hồ, nhưng có thể là H2O, (-)OSO3H hoặc một phân tử alcohol khác) sau đó có thể phá vỡ C-H, dẫn đến sự hình thành alkene.
9. Tóm tắt: Phản ứng loại trừ của Alcohol (E1)
Nếu bạn thấy một alcohol bậc ba hoặc bậc hai với H2SO4, TsOH hoặc H3PO4 (và đặc biệt nếu bạn thấy “nhiệt”), hãy nghĩ: sự hình thành carbocation sau đó là phản ứng loại trừ (E1).
Và nếu bạn thấy rằng một carbocation ổn định hơn có thể được hình thành thông qua sự di chuyển của một nhóm H hoặc alkyl liền kề, hãy mong đợi điều đó sẽ xảy ra.
Nếu bạn thấy một alcohol bậc một với H2SO4, TsOH hoặc H3PO4, hãy mong đợi sự hình thành ether đối xứng đi kèm với sự loại trừ để tạo thành alkene.
So sánh H2SO4 và HCl trong phản ứng loại nước của alcohol
- H2SO4: Thường tạo ra sản phẩm loại trừ (alkene) do HSO4- là một nucleophile kém. Cơ chế chính là E1 (cho alcohol bậc ba và bậc hai) và E2 (cho alcohol bậc một).
- HCl: Thường tạo ra sản phẩm thế (alkyl halide) do Cl- là một nucleophile tốt hơn. Cơ chế chính là SN1 (cho alcohol bậc ba) và SN2 (cho alcohol bậc một và bậc hai, mặc dù có thể có sự sắp xếp lại carbocation).
Yếu tố ảnh hưởng đến hướng phản ứng:
- Cấu trúc alcohol: Alcohol bậc ba dễ dàng tạo carbocation hơn, do đó ưu tiên cơ chế E1/SN1. Alcohol bậc một và bậc hai có thể đi theo cả cơ chế E2/SN2.
- Nhiệt độ: Nhiệt độ cao hơn thường ưu tiên phản ứng loại trừ.
- Nồng độ axit: Nồng độ axit cao hơn có thể ảnh hưởng đến cơ chế phản ứng và sản phẩm.
Việc hiểu rõ sự khác biệt giữa H2SO4 và HCl trong phản ứng loại nước của alcohol là rất quan trọng trong hóa học hữu cơ để dự đoán và kiểm soát sản phẩm phản ứng.