Để xác định dung dịch muối nào có thể tác dụng được với cả Niken (Ni) và Chì (Pb), chúng ta cần xem xét đến tính chất hóa học của các kim loại này và vị trí của chúng trong dãy điện hóa. Bài viết này sẽ cung cấp lời giải chi tiết, cùng với những kiến thức mở rộng và bài tập vận dụng để bạn đọc hiểu rõ hơn về vấn đề này.
Xác Định Dung Dịch Muối Tác Dụng Được Với Ni và Pb
Câu hỏi đặt ra là: Dung Dịch Muối Nào Sau đây Tác Dụng được Với Cả Ni Và Pb?
A. Fe(NO3)2
B. Ni(NO3)2
C. Cu(NO3)2
D. Pb(NO3)2
Giải thích:
Dựa vào dãy điện hóa, ta có thứ tự tính oxi hóa như sau: Cu2+ > Pb2+ > Ni2+ > Fe2+. Điều này có nghĩa là ion Cu2+ có khả năng oxi hóa cả Pb và Ni thành ion Pb2+ và Ni2+ tương ứng.
Phương trình phản ứng minh họa:
- Cu2+ + Pb → Pb2+ + Cu
- Cu2+ + Ni → Ni2+ + Cu
Vậy, đáp án đúng là C. Cu(NO3)2.
Ý Nghĩa của Dãy Điện Hóa Kim Loại
Dãy điện hóa kim loại là một công cụ quan trọng giúp dự đoán khả năng phản ứng giữa các kim loại và dung dịch muối. Một số điểm cần lưu ý:
- Tính khử tăng dần: Kim loại đứng trước trong dãy có tính khử mạnh hơn và dễ dàng đẩy kim loại đứng sau ra khỏi dung dịch muối.
- Tính oxi hóa tăng dần: Ion kim loại đứng sau có tính oxi hóa mạnh hơn và có khả năng oxi hóa kim loại đứng trước.
Tuy nhiên, cần lưu ý một số trường hợp ngoại lệ:
- Kim loại kiềm: Các kim loại kiềm phản ứng mạnh với nước thay vì khử ion kim loại khác.
- Kim loại với axit: Các kim loại từ Mg đến trước H trong dãy điện hóa có thể tác dụng với axit giải phóng khí hidro.
- Tính thụ động: Al, Fe, Cr bị thụ động hóa trong HNO3 và H2SO4 đặc nguội.
- Kim loại trơ: Các kim loại như Au, Pt không phản ứng với axit thông thường.
Quy Tắc Alpha (α) và Ứng Dụng
Quy tắc alpha giúp xác định chiều của phản ứng oxi hóa khử. Phản ứng sẽ xảy ra theo chiều từ chất oxi hóa mạnh hơn và chất khử mạnh hơn tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
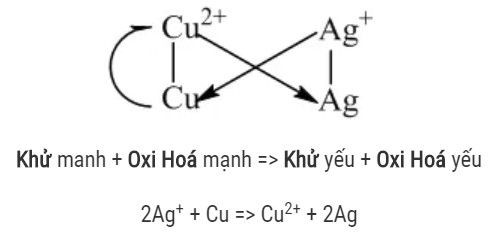 Mô tả quy tắc alpha (α) trong dãy điện hóa, giúp xác định chiều phản ứng oxi hóa khử giữa các cặp oxi hóa khử.
Mô tả quy tắc alpha (α) trong dãy điện hóa, giúp xác định chiều phản ứng oxi hóa khử giữa các cặp oxi hóa khử.
Alt text: Quy tắc Alpha trong dãy điện hóa: minh họa trực quan chiều phản ứng oxi hóa khử, tập trung vào các yếu tố oxi hóa và khử.
Bài Tập Vận Dụng
Câu 1: Cho các kim loại: Ni, Fe, Cu, Zn. Số kim loại tác dụng với dung dịch Pb(NO3)2 là:
A. 4
B. 3
C. 2
D. 1
Đáp án: B. 3 (Ni, Fe, Zn)
Giải thích: Các kim loại đứng trước Pb trong dãy điện hóa có thể đẩy Pb ra khỏi muối.
Câu 2: Cho dãy các kim loại: Na, Cu, Fe, Ag, Zn, Al, Ba. Số kim loại trong dãy phản ứng được với dung dịch HCl là:
A. 4
B. 2
C. 6
D. 5
Đáp án: D. 5 (Na, Fe, Zn, Al, Ba)
Giải thích: Các kim loại đứng trước H trong dãy điện hóa có thể phản ứng với HCl.
Câu 3: Các hỗn hợp chất nào sau đây không cùng tồn tại trong cùng một dung dịch?
A. Ni(NO3)2 và AgNO3
B. Fe(NO3)2 và AgNO3
C. Fe(NO3)2 và Cu(NO3)2
D. Hg(NO3)2 và Cu(NO3)2
Đáp án: B. Fe(NO3)2 và AgNO3
Giải thích: Ag+ có tính oxi hóa mạnh hơn Fe2+, do đó xảy ra phản ứng: Ag+ + Fe2+ -> Ag + Fe3+
Kết Luận
Hiểu rõ về dãy điện hóa và quy tắc alpha là chìa khóa để giải quyết các bài toán liên quan đến phản ứng oxi hóa khử giữa kim loại và dung dịch muối. Hy vọng bài viết này đã cung cấp cho bạn đọc những kiến thức hữu ích và giúp bạn tự tin hơn khi đối mặt với các dạng bài tập tương tự.
