Công thức hóa học là nền tảng quan trọng trong môn Hóa học, đặc biệt đối với học sinh lớp 7. Việc hiểu rõ và vận dụng thành thạo các công thức này sẽ giúp các em dễ dàng tiếp thu những kiến thức nâng cao hơn trong tương lai. Bài viết này sẽ cung cấp một cái nhìn tổng quan và chi tiết về Công Thức Hóa Học Lớp 7, giúp các em học sinh nắm vững kiến thức và đạt kết quả tốt trong học tập.
I. Công Thức Hóa Học: Biểu Diễn Thế Giới Vi Mô
Công thức hóa học là một cách biểu diễn ngắn gọn và chính xác một chất hóa học. Nó sử dụng các ký hiệu hóa học của các nguyên tố và các chỉ số để chỉ ra thành phần và tỷ lệ của các nguyên tử trong một phân tử.
- Công thức hóa học cho biết:
- Các nguyên tố hóa học tạo nên chất.
- Số lượng nguyên tử của mỗi nguyên tố trong một phân tử.
- Khối lượng phân tử của chất.
Ví dụ, công thức hóa học của nước là H₂O cho biết nước được tạo thành từ hai nguyên tố là hydro (H) và oxy (O), với hai nguyên tử hydro và một nguyên tử oxy trong mỗi phân tử nước.
Cách Viết Công Thức Hóa Học:
-
Đơn chất:
- Kim loại, khí hiếm và một số phi kim: Ký hiệu hóa học của nguyên tố. Ví dụ: Đồng (Cu), Sắt (Fe), Neon (Ne).
- Một số phi kim (O₂, H₂, Cl₂,…): Ký hiệu hóa học của nguyên tố kèm theo chỉ số ở chân bên phải (thường là 2).
-
Hợp chất: Ký hiệu hóa học của các nguyên tố tạo nên hợp chất, kèm theo chỉ số ở chân bên phải. Chỉ số cho biết số nguyên tử của mỗi nguyên tố (chỉ số 1 không cần ghi). Ví dụ: Natri clorua (NaCl), Axit clohydric (HCl).
Ý nghĩa của công thức hóa học:
Công thức hóa học không chỉ đơn thuần là một ký hiệu, mà nó còn mang nhiều ý nghĩa quan trọng:
- Thành phần nguyên tố: Cho biết những nguyên tố nào tạo nên chất đó.
- Tỷ lệ nguyên tử: Cho biết tỷ lệ số lượng nguyên tử của mỗi nguyên tố trong phân tử.
- Khối lượng phân tử: Có thể tính được khối lượng phân tử của chất dựa trên công thức hóa học và khối lượng nguyên tử của các nguyên tố.
Ví dụ: Công thức hóa học của khí cacbonic là CO₂ cho biết:
- Cacbonic được tạo thành từ hai nguyên tố: cacbon (C) và oxy (O).
- Trong một phân tử cacbonic, có 1 nguyên tử cacbon và 2 nguyên tử oxy.
- Khối lượng phân tử của cacbonic = 12 + 16 x 2 = 44 amu.
II. Hóa Trị: Khả Năng Liên Kết Của Nguyên Tố
Hóa trị là một khái niệm quan trọng để hiểu cách các nguyên tử liên kết với nhau tạo thành phân tử. Hóa trị của một nguyên tố là số liên kết mà một nguyên tử của nguyên tố đó có thể tạo thành với các nguyên tử khác.
Quy Tắc Hóa Trị:
Trong một hợp chất, tích của hóa trị và số lượng nguyên tử của nguyên tố này phải bằng tích của hóa trị và số lượng nguyên tử của nguyên tố kia. Điều này giúp chúng ta xác định công thức hóa học chính xác của hợp chất.
Ví dụ: Trong phân tử nước (H₂O), hydro có hóa trị I và oxy có hóa trị II. Ta có:
- Hóa trị của H x Số nguyên tử H = Hóa trị của O x Số nguyên tử O
- I x 2 = II x 1
III. Lập Công Thức Hóa Học: Vận Dụng Kiến Thức
1. Khi Biết Hóa Trị:
- Bước 1: Viết công thức tổng quát: AxBy (A, B là các nguyên tố, x, y là chỉ số)
- Bước 2: Xác định hóa trị của A và B (gọi là a và b).
- Bước 3: Áp dụng quy tắc hóa trị: a.x = b.y => x/y = b/a
- Bước 4: Rút gọn tỷ lệ x/y thành phân số tối giản.
- Bước 5: Viết công thức hóa học đúng.
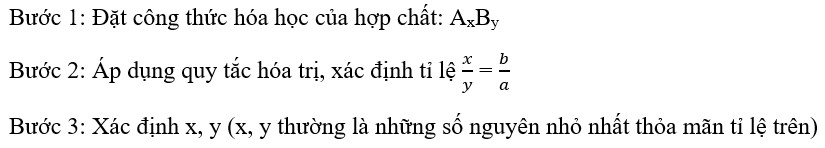 Sơ đồ các bước lập công thức hóa học khi biết hóa trị các nguyên tố
Sơ đồ các bước lập công thức hóa học khi biết hóa trị các nguyên tố
Ví dụ: Lập công thức hóa học của hợp chất tạo bởi Al (hóa trị III) và O.
- Bước 1: AlₓOᵧ
- Bước 2: Al (III), O (II)
- Bước 3: 3.x = 2.y => x/y = 2/3
- Bước 4: x = 2, y = 3
- Bước 5: Al₂O₃
2. Khi Biết Phần Trăm Khối Lượng Các Nguyên Tố:
- Bước 1: Đặt công thức hóa học: AₓBᵧ
- Bước 2: Giả sử khối lượng hợp chất là 100g. Tính khối lượng của A và B trong 100g hợp chất dựa vào phần trăm khối lượng.
- Bước 3: Tính số mol của A và B.
- Bước 4: Lập tỉ lệ số mol của A và B để tìm x và y.
- Bước 5: Viết công thức hóa học.
IV. Bảng Hóa Trị Thường Gặp:
Để giúp các em học sinh dễ dàng hơn trong việc học tập và làm bài tập, dưới đây là bảng hóa trị của một số nguyên tố và nhóm nguyên tử thường gặp:
| Nguyên tố/Nhóm nguyên tử | Hóa trị |
|---|---|
| Hydro (H) | I |
| Oxy (O) | II |
| Natri (Na), Kali (K), Bạc (Ag) | I |
| Magie (Mg), Canxi (Ca), Kẽm (Zn) | II |
| Nhôm (Al) | III |
| Clo (Cl), Brom (Br), Iot (I) | I |
| Nhóm hidroxit (OH) | I |
| Nhóm nitrat (NO₃) | I |
| Nhóm sunfat (SO₄) | II |
| Nhóm photphat (PO₄) | III |
V. Bài Tập Vận Dụng:
Để củng cố kiến thức, các em học sinh nên làm nhiều bài tập vận dụng khác nhau. Dưới đây là một số ví dụ:
-
Lập công thức hóa học của các hợp chất sau:
- Kali và oxy.
- Magie và clo.
- Nhôm và sunfat.
-
Một hợp chất có thành phần là 40% lưu huỳnh và 60% oxy. Biết khối lượng phân tử của hợp chất là 80 amu. Xác định công thức hóa học của hợp chất.
Kết luận:
Nắm vững công thức hóa học lớp 7 là bước khởi đầu quan trọng để chinh phục môn Hóa học. Bằng cách hiểu rõ khái niệm, quy tắc và luyện tập thường xuyên, các em học sinh sẽ có nền tảng vững chắc để học tốt môn học này. Chúc các em thành công!
