Khái niệm về “Một Nguyên Tử” đã xuất hiện từ hàng nghìn năm trước. Lịch sử nghiên cứu về nguyên tử trải qua nhiều giai đoạn, từ thời cổ Hy Lạp đến những khám phá của Henri Becquerel và Marie Curie.
Nguồn gốc của thuyết nguyên tử
Thuyết nguyên tử bắt nguồn từ “Atomos” trong tiếng Hy Lạp cổ, có nghĩa là “bất khả phân”. Thuyết này cho rằng vật chất được cấu tạo từ các hạt rời rạc. Đây là một trong những cách giải thích về vật chất và không gian dựa trên các bằng chứng thực nghiệm.
Các cột mốc quan trọng trong lý thuyết về “một nguyên tử”:
-
1805: John Dalton, nhà hóa học, vật lý học và khí tượng học người Anh, sử dụng khái niệm về nguyên tử để giải thích các phản ứng hóa học theo tỉ lệ số nguyên đơn giản và sự hòa tan khác nhau của các khí trong nước.
“Mỗi nguyên tố hóa học chứa các nguyên tử giống nhau, duy nhất, và chúng kết hợp với nhau tạo thành hợp chất hóa học.” (Wikipedia.org)
Lý thuyết này chưa đề cập đến kích thước cụ thể của “một nguyên tử”, mà chỉ mô tả chúng là “rất nhỏ”.
-
1827: Robert Brown, nhà thực vật học người Scotland, quan sát các hạt bụi trong nước dưới kính hiển vi và nhận thấy chúng di chuyển theo đường zig-zag.
-
1865: Johann Josef Loschmidt, nhà khoa học người Áo, tìm ra kích thước của phân tử trong không khí, một bước tiến quan trọng trong việc nghiên cứu “một nguyên tử”.
-
1905: Albert Einstein, nhà vật lý học người Đức, phân tích thành công khối lượng và kích thước của “một nguyên tử”, đồng thời củng cố thuyết nguyên tử của Dalton.
“Một nguyên tử” là gì?
Mặc dù có hàng triệu chất khác nhau, nhưng chỉ có hơn 100 loại “một nguyên tử”. Hãy tưởng tượng “một nguyên tử” như một quả cầu vô cùng nhỏ, với đường kính chỉ khoảng 0.00000001 cm.
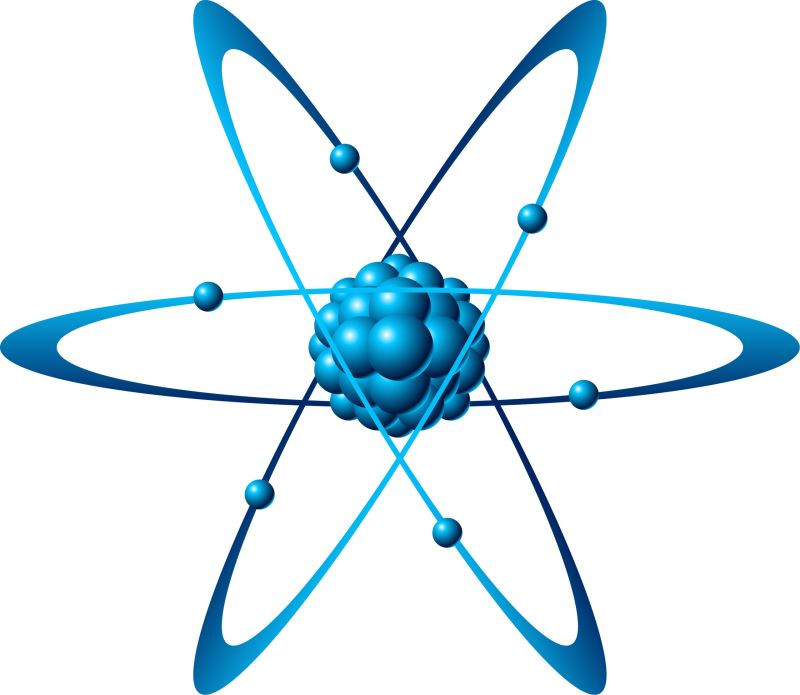
Mô tả: Hình ảnh mô phỏng cấu trúc của “một nguyên tử” với hạt nhân ở trung tâm và các electron chuyển động xung quanh.
Theo sách giáo khoa Hóa học 8, “Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.”
Electron, ký hiệu là e, mang điện tích âm nhỏ nhất.
Cấu tạo của “một nguyên tử”
Từ định nghĩa trên, ta thấy rằng “một nguyên tử” được cấu tạo từ hai thành phần chính:
- Hạt nhân mang điện tích dương.
- Vỏ tạo bởi một hoặc nhiều electron mang điện tích âm.
Các khái niệm liên quan đến “một nguyên tử”
Để hiểu rõ hơn về bản chất của “một nguyên tử”, chúng ta cần tìm hiểu thêm về hạt nhân nguyên tử, lớp electron và nguyên tử khối.
Mô tả: Sơ đồ minh họa các thành phần của “một nguyên tử” bao gồm hạt nhân (proton và neutron) và các lớp electron.
Hạt nhân nguyên tử
Hạt nhân nguyên tử, nằm ở trung tâm, được tạo thành từ proton (p) mang điện tích dương và neutron (n) không mang điện. Các nguyên tử cùng loại có cùng số proton trong hạt nhân.
Số proton = Số electron trong một nguyên tử trung hòa về điện. Proton và neutron có khối lượng tương đương, trong khi electron có khối lượng rất nhỏ (khoảng 0.0005 lần khối lượng proton). Vì vậy, khối lượng hạt nhân được coi là khối lượng của nguyên tử.
Lớp electron
Electron chuyển động rất nhanh quanh hạt nhân và được sắp xếp thành từng lớp với số lượng electron nhất định. Electron cho phép các nguyên tử liên kết với nhau.
Số nguyên tử
Mỗi nguyên tố hóa học trong bảng tuần hoàn có một số nguyên tử riêng, giúp phân biệt các nguyên tố.
Số nguyên tử là số lượng proton trong hạt nhân của nguyên tử. Trong nguyên tử trung hòa, số nguyên tử bằng số electron.
Nguyên tử khối
“Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon. Mỗi nguyên tố có nguyên tử khối riêng biệt.” (Sách giáo khoa Hóa học 8).
Vì khối lượng của “một nguyên tử” rất nhỏ, các nhà khoa học quy ước lấy 1/12 khối lượng của nguyên tử cacbon làm đơn vị khối lượng nguyên tử (đvC).
Phân biệt “một nguyên tử” và phân tử
Nhiều người nhầm lẫn giữa nguyên tử và phân tử. Dưới đây là bảng so sánh để phân biệt hai khái niệm này:
| Đặc điểm so sánh | Nguyên tử | Phân tử |
|---|---|---|
| Khái niệm | Hạt vô cùng nhỏ, trung hòa về điện, gồm hạt nhân mang điện tích dương và vỏ electron. | Hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau, thể hiện tính chất hóa học của chất. |
| Ví dụ | Nguyên tử oxi (O), nguyên tử cacbon (C) | Phân tử oxy (O2), phân tử nước (H2O) |
| Hình dạng | Hình cầu | Đa dạng |
| Tính chất | Không thể phân đôi | Có thể tách rời và kết hợp các nguyên tố |
| Sự tồn tại | Có thể hoặc không tồn tại tự do | Tồn tại tự do |
| Tầm nhìn | Không nhìn thấy bằng mắt thường | Không nhìn thấy bằng mắt thường, có thể quan sát bằng kính hiển vi |
| Khả năng phản ứng | Phản ứng cao (có ngoại lệ) | Ít phản ứng |
| Liên kết | Liên kết hạt nhân | Liên kết cộng hóa trị hoặc liên kết ion |

Bài tập củng cố kiến thức về “một nguyên tử”
Sau khi nắm vững lý thuyết, hãy làm các bài tập để củng cố kiến thức. Dưới đây là một vài ví dụ:
Bài 1: Ôn tập khái niệm
“(1) là hạt vô cùng nhỏ, trung hòa về điện, từ (2) tạo ra mọi chất. Nguyên tử gồm (3) mang điện tích dương và vỏ tạo bởi (4).”
Đáp án:
(1): Nguyên tử
(2): nguyên tử
(3): hạt nhân
(4): một hay nhiều electron mang điện tích âm
Bài 2: Bài tập SGK Hóa học 8 trang 25
Kim loại đồng, sắt được tạo nên từ nguyên tố nào? Nêu sự sắp xếp nguyên tử trong đơn chất kim loại.
Đáp án:
Kim loại đồng được tạo nên từ nguyên tố Cu; kim loại sắt được tạo nên từ nguyên tố Fe.
Sự sắp xếp nguyên tử trong đơn chất kim loại: Sắp xếp khít nhau và theo một trật tự xác định.
Bài học về nguyên tử là nền tảng quan trọng trong chương trình Hóa học THCS. Hãy ôn tập kỹ lưỡng và làm bài tập đầy đủ để nắm vững kiến thức này!
