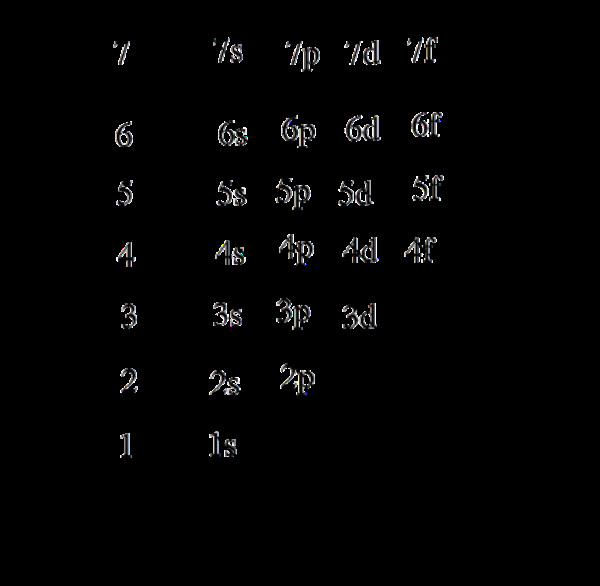Cấu hình electron là chìa khóa để hiểu rõ tính chất hóa học của các nguyên tố. Bài viết này sẽ cung cấp kiến thức toàn diện về Bảng Cấu Hình Electron, từ cơ bản đến nâng cao, giúp bạn nắm vững kiến thức và tự tin giải mọi bài tập.
1. Thứ Tự Các Mức Năng Lượng Trong Nguyên Tử
Trong trạng thái cơ bản, electron (e) chiếm các mức năng lượng từ thấp đến cao. Các lớp electron được lấp đầy từ trong ra ngoài (từ 1 đến 7), và các phân lớp được lấp đầy theo thứ tự tăng dần của năng lượng: s, p, d, f.
Thứ tự năng lượng của các phân lớp được sắp xếp như sau: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s… Do hiệu ứng chèn ép mức năng lượng khi điện tích hạt nhân tăng lên, mức năng lượng 4s thấp hơn 3d.
2. Cấu Hình Electron Nguyên Tử
Cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Cách viết cấu hình electron:
- Xác định số electron: Xác định số electron của nguyên tử (bằng số proton, Z).
- Phân bố electron: Phân bố electron vào các phân lớp theo thứ tự tăng dần năng lượng, tuân theo nguyên lý Pauli, nguyên lý vững bền và quy tắc Hund.
- Viết cấu hình electron: Viết cấu hình electron theo thứ tự các phân lớp trong mỗi lớp, và theo thứ tự các lớp electron.
Lưu ý: Mặc dù electron được phân bố theo thứ tự năng lượng tăng dần (có sự chèn mức năng lượng), khi viết cấu hình electron, cần sắp xếp lại theo thứ tự lớp.
Ví dụ: Natri (Na), Z = 11.
- Có 11 electron.
- Phân bố electron: 1s² 2s² 2p⁶ 3s¹.
- Viết gọn: [Ne] 3s¹ ([Ne] là cấu hình electron của Neon).
2.1. Cấu hình electron biểu diễn điều gì?
Cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau trong nguyên tử.
2.2. Cách viết cấu hình electron
2.2.1. Quy ước cách viết
- Số thứ tự lớp electron: 1, 2, 3…
- Ký hiệu phân lớp: s, p, d, f
- Số electron trên phân lớp: ghi ở phía trên bên phải ký hiệu phân lớp (ví dụ: s², p⁶, d¹⁰…)
2.2.2. Nguyên tắc và quy tắc cần tuân thủ
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa 2 electron có spin ngược nhau.
- Quy tắc Hund: Trong cùng một phân lớp, electron phân bố sao cho số electron độc thân là tối đa và có spin song song.
- Nguyên lý vững bền: Electron chiếm orbital có mức năng lượng thấp nhất trước.
2.2.3. Các bước viết cấu hình electron
- Xác định số electron.
- Phân bố electron: Theo thứ tự tăng dần năng lượng: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p…, tuân thủ:
- Phân lớp s: tối đa 2e.
- Phân lớp p: tối đa 6e.
- Phân lớp d: tối đa 10e.
- Phân lớp f: tối đa 14e.
- Viết cấu hình electron: Phân bố electron trên các phân lớp thuộc các lớp khác nhau.
2.2.4. Xác định nguyên tố s, p, d, f
- Nguyên tố s: Electron cuối cùng thuộc phân lớp s.
- Nguyên tố p: Electron cuối cùng thuộc phân lớp p.
- Nguyên tố d: Electron cuối cùng thuộc phân lớp d.
- Nguyên tố f: Electron cuối cùng thuộc phân lớp f.
Lưu ý: Một số trường hợp đặc biệt (bán bão hòa):
- Cr (Z = 24): Thay vì 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁴ 4s², trở thành 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵ 4s¹.
- Cu (Z = 29): Thay vì 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁹ 4s², trở thành 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s¹.
3. Đặc Điểm Lớp Electron Ngoài Cùng
Lớp electron ngoài cùng quyết định tính chất hóa học của nguyên tố.
- Hầu hết các nguyên tố có tối đa 8 electron ở lớp ngoài cùng.
- 8 electron ở lớp ngoài cùng tạo cấu hình bền (khí hiếm).
- 1, 2, 3 electron ở lớp ngoài cùng: dễ nhường electron (kim loại).
- 5, 6, 7 electron ở lớp ngoài cùng: dễ nhận electron (phi kim).
- 4 electron ở lớp ngoài cùng: có thể là kim loại hoặc phi kim.
4. Bảng Cấu Hình Electron của 20 Nguyên Tố Đầu Tiên
Bảng cấu hình electron giúp dễ dàng tra cứu và so sánh cấu hình của các nguyên tố.
5. Sơ Đồ Tư Duy Cấu Hình Electron
Sơ đồ tư duy giúp hệ thống hóa kiến thức và ghi nhớ dễ dàng hơn.
6. Bài Tập Áp Dụng
6.1. Bài tập cơ bản và nâng cao
Ví dụ 1: Nguyên tố X có 3 lớp electron, lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử và viết cấu hình electron của X.
Giải:
- Z = 2 + 8 + 4 = 14
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p²
Ví dụ 2: Nguyên tố d có 4 lớp electron, phân lớp ngoài cùng bão hòa electron. Tính tổng số electron s và p của d.
Giải:
- 4 lớp electron → electron cuối cùng thuộc 3d.
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s²
- Tổng số electron s và p: 2 + 2 + 6 + 2 + 6 = 18
Ví dụ 3: Nguyên tử X có ký hiệu là X₂₆⁵⁶. Viết cấu hình electron và xác định X là kim loại hay phi kim.
Giải:
- Phân bố electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
- Cấu hình electron: [Ar] 3d⁶ 4s²
- Lớp ngoài cùng có 2 electron → X là kim loại.
Ví dụ 4: Số electron lớp ngoài cùng của các nguyên tố có Z = 3, 6, 9, 18 là bao nhiêu?
Giải:
- Z = 3: 1s² 2s¹ → 1e
- Z = 6: 1s² 2s² 2p² → 4e
- Z = 9: 1s² 2s² 2p⁵ → 7e
- Z = 18: 1s² 2s² 2p⁶ 3s² 3p⁶ → 8e
Ví dụ 5: Có bao nhiêu nguyên tố có lớp ngoài cùng thuộc lớp M?
Giải:
- Lớp M (n = 3)
- 8 nguyên tố:
- 1s² 2s² 2p⁶ 3s¹
- 1s² 2s² 2p⁶ 3s²
- 1s² 2s² 2p⁶ 3s² 3p¹
- 1s² 2s² 2p⁶ 3s² 3p²
- 1s² 2s² 2p⁶ 3s² 3p³
- 1s² 2s² 2p⁶ 3s² 3p⁴
- 1s² 2s² 2p⁶ 3s² 3p⁵
- 1s² 2s² 2p⁶ 3s² 3p⁶
6.2. Bài tập trắc nghiệm
(Lưu ý: Đáp án đã được cung cấp trong bài viết gốc)
Nắm vững kiến thức về cấu hình electron là nền tảng quan trọng để học tốt môn Hóa học. Hãy luyện tập thường xuyên để thành thạo kỹ năng viết cấu hình electron và vận dụng vào giải các bài tập liên quan. Chúc các bạn thành công!