Tương Tác Van Der Waals là một loại lực hút yếu giữa các phân tử hoặc nguyên tử, đóng vai trò quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng thực tế. Mặc dù yếu hơn nhiều so với liên kết ion, liên kết cộng hóa trị hay thậm chí liên kết hydrogen, nhưng tương tác Van der Waals lại có mặt ở khắp mọi nơi và ảnh hưởng đáng kể đến tính chất vật lý của vật chất.
Bản Chất Của Tương Tác Van Der Waals
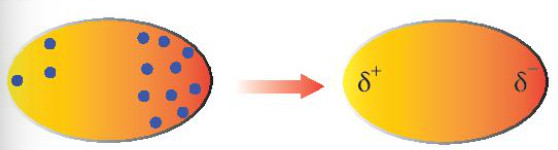
Tương tác Van der Waals phát sinh từ sự phân bố điện tích không đồng đều tạm thời trong các phân tử hoặc nguyên tử. Các electron trong phân tử luôn chuyển động. Tại một thời điểm nhất định, electron có thể tập trung nhiều hơn về một phía, tạo ra một lưỡng cực tạm thời (dipole moment).
Lưỡng cực tạm thời này có thể gây ra sự phân cực trong các phân tử lân cận, tạo ra các lưỡng cực cảm ứng. Kết quả là, các phân tử sẽ hút nhau thông qua tương tác giữa các lưỡng cực tạm thời và cảm ứng. Đây chính là bản chất của tương tác Van der Waals. Có ba loại tương tác Van der Waals chính:
- Tương tác lưỡng cực – lưỡng cực (dipole-dipole): Xảy ra giữa các phân tử phân cực, có lưỡng cực vĩnh viễn.
- Tương tác lưỡng cực – lưỡng cực cảm ứng (dipole-induced dipole): Xảy ra giữa một phân tử phân cực và một phân tử không phân cực.
- Lực London (dispersion force): Xảy ra giữa tất cả các phân tử, kể cả phân tử không phân cực, do sự hình thành các lưỡng cực tạm thời.
Ảnh Hưởng Của Tương Tác Van Der Waals Đến Tính Chất Vật Lý
Tương tác Van der Waals ảnh hưởng đến nhiều tính chất vật lý của vật chất, đặc biệt là nhiệt độ nóng chảy và nhiệt độ sôi. Mặc dù yếu, nhưng tổng hợp của nhiều tương tác Van der Waals có thể tạo ra một lực đáng kể.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Các chất có tương tác Van der Waals mạnh hơn thường có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn. Khi khối lượng phân tử tăng, kích thước phân tử tăng, dẫn đến số lượng electron tăng, làm tăng tương tác Van der Waals. Ví dụ, các khí hiếm có nhiệt độ sôi tăng dần khi đi xuống nhóm trong bảng tuần hoàn (He < Ne < Ar < Kr < Xe) do khối lượng nguyên tử tăng.
- Độ nhớt: Độ nhớt của chất lỏng cũng bị ảnh hưởng bởi tương tác Van der Waals. Các chất lỏng có tương tác Van der Waals mạnh hơn thường có độ nhớt cao hơn.
- Sức căng bề mặt: Tương tác Van der Waals cũng đóng vai trò quan trọng trong sức căng bề mặt của chất lỏng.
Ứng Dụng Thực Tế Của Tương Tác Van Der Waals
Mặc dù là lực tương tác yếu, tương tác Van der Waals có nhiều ứng dụng quan trọng trong thực tế:
- Sự bám dính: Tương tác Van der Waals là nguyên nhân chính gây ra sự bám dính giữa các bề mặt, ví dụ như sự bám dính của thạch sùng lên tường.
- Hấp phụ: Tương tác Van der Waals đóng vai trò quan trọng trong quá trình hấp phụ, ví dụ như sự hấp phụ các chất độc hại bởi than hoạt tính.
- Chất kết dính: Nhiều loại keo dán hoạt động dựa trên tương tác Van der Waals để kết nối các bề mặt.
- Vật liệu nano: Tương tác Van der Waals được sử dụng để lắp ráp các cấu trúc nano, tạo ra các vật liệu có tính chất đặc biệt.
Phân Biệt Tương Tác Van Der Waals và Liên Kết Hydrogen
Cả tương tác Van der Waals và liên kết hydrogen đều là các lực liên kết giữa các phân tử, nhưng có một số điểm khác biệt quan trọng:
- Độ mạnh: Liên kết hydrogen mạnh hơn đáng kể so với tương tác Van der Waals.
- Điều kiện hình thành: Liên kết hydrogen chỉ hình thành giữa các nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện cao (như O, N, F) và các nguyên tử có cặp electron tự do. Tương tác Van der Waals có thể xảy ra giữa tất cả các phân tử.
- Bản chất: Liên kết hydrogen là một loại tương tác lưỡng cực – lưỡng cực đặc biệt mạnh, trong khi tương tác Van der Waals bao gồm nhiều loại tương tác khác nhau.
Tóm lại, tương tác Van der Waals là một lực tương tác yếu nhưng phổ biến, ảnh hưởng đến nhiều tính chất vật lý của vật chất và có nhiều ứng dụng quan trọng trong thực tế. Hiểu rõ về tương tác Van der Waals là rất quan trọng trong nhiều lĩnh vực khoa học và công nghệ.