Trong hóa học, độ tan là một thuộc tính quan trọng để hiểu về khả năng hòa tan của một chất trong một dung môi nhất định, thường là nước. Bài viết này sẽ đi sâu vào khái niệm “Chất Nào ít Tan Trong Nước”, các yếu tố ảnh hưởng đến độ tan và cung cấp bảng tra cứu tính tan hữu ích.
Độ Tan và Phân Loại Khả Năng Hòa Tan
Độ tan (hay độ hòa tan) là số gam chất tan có thể hòa tan trong 100g dung môi (thường là nước) để tạo thành dung dịch bão hòa ở một nhiệt độ nhất định. Dựa vào độ tan, người ta phân loại chất tan như sau:
- Chất tan tốt (dễ tan): Trên 10g chất tan trong 100g nước.
- Chất ít tan: Dưới 1g chất tan trong 100g nước.
- Chất không tan: Dưới 0.01g chất tan trong 100g nước.
Vậy, “chất nào ít tan trong nước” là những chất có độ tan dưới 1g/100g nước.
Các Loại Chất Ít Tan Trong Nước
Nhìn chung, các chất sau thường ít tan trong nước:
- Bazơ: Hầu hết các bazơ (hydroxit kim loại) đều ít tan, ngoại trừ các bazơ của kim loại kiềm (như NaOH, KOH) và Ba(OH)2. Ca(OH)2 cũng tan nhưng ở mức độ hạn chế (ít tan).
- Muối: Nhiều muối ít tan hoặc không tan trong nước. Ví dụ, phần lớn các muối cacbonat (CO32-) và photphat (PO43-) của kim loại không phải kiềm thường không tan. Một số muối sunfat (SO42-), clorua (Cl-), bromua (Br-), iotua (I-) cũng ít tan hoặc không tan.
- Axit: Axit silixic (H2SiO3) là một axit không tan trong nước.
- Chất hữu cơ: Nhiều hợp chất hữu cơ, đặc biệt là các hydrocacbon (chỉ chứa cacbon và hydro) và các hợp chất có mạch cacbon dài, thường ít tan trong nước do tính chất không phân cực của chúng.
Các Yếu Tố Ảnh Hưởng Đến Độ Tan
Độ tan của một chất phụ thuộc vào nhiều yếu tố, bao gồm:
-
Nhiệt độ:
- Đối với chất rắn, độ tan thường tăng khi nhiệt độ tăng (cho các quá trình hòa tan thu nhiệt). Tuy nhiên, có một số chất rắn có độ tan giảm khi nhiệt độ tăng (quá trình hòa tan tỏa nhiệt).
- Đối với chất khí, độ tan giảm khi nhiệt độ tăng.
-
Áp suất (đối với chất khí): Độ tan của chất khí trong chất lỏng tỉ lệ thuận với áp suất của chất khí đó (định luật Henry).
-
Độ phân cực: “Chất nào ít tan trong nước” thường là những chất ít phân cực hoặc không phân cực. Nước là một dung môi phân cực, do đó, các chất phân cực sẽ tan tốt hơn trong nước (“tương tự hòa tan tương tự”).
-
Các yếu tố khác: Dạng thù hình, hiện tượng hydrat hóa, hiện tượng đa hình, độ pH của dung dịch, sự có mặt của các ion cùng tên và hỗn hợp dung môi cũng ảnh hưởng đến độ tan.
Công Thức Tính Độ Tan
Độ tan (S) có thể được tính bằng công thức:
S = (mct / mdm) x 100
Trong đó:
- S: Độ tan (g chất tan/100g dung môi)
- mct: Khối lượng chất tan (g)
- mdm: Khối lượng dung môi (g)
Bảng Tính Tan Tham Khảo (Muối, Axit, Bazơ)
Bảng tính tan cung cấp thông tin nhanh chóng về khả năng tan của các hợp chất. Dưới đây là một bảng tính tan đơn giản:
| Ion | OH- | Cl- | SO42- | CO32- | NO3- |
|---|---|---|---|---|---|
| Na+ | T | T | T | T | T |
| K+ | T | T | T | T | T |
| Ca2+ | ÍT | T | ÍT | K | T |
| Ba2+ | T | T | K | K | T |
| Ag+ | K | K | ÍT | K | T |
| Cu2+ | K | T | T | K | T |
| Fe3+ | K | T | T | K | T |

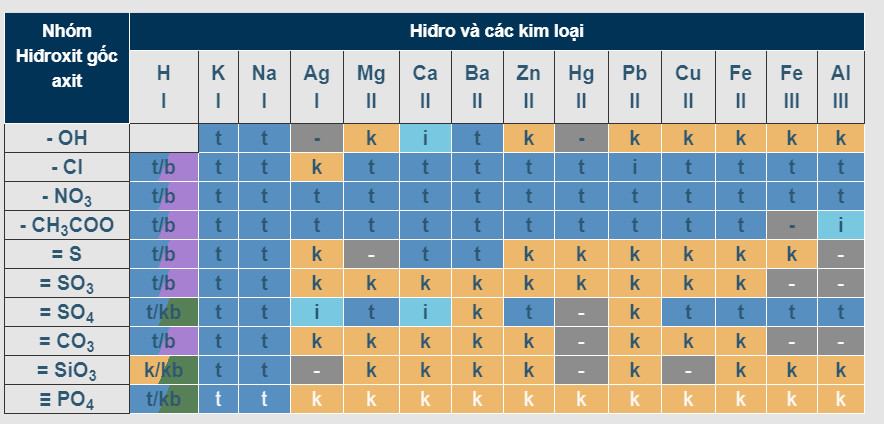
- T: Tan
- ÍT: Ít Tan
- K: Không Tan
Lưu ý: Bảng tính tan chỉ mang tính chất tham khảo. Độ tan thực tế có thể thay đổi tùy thuộc vào điều kiện cụ thể.
Cách Đọc Bảng Tính Tan
Để xác định tính tan của một chất, ví dụ CaCO3, bạn tìm ion Ca2+ ở cột dọc và ion CO32- ở hàng ngang. Giao điểm của hàng và cột cho biết CaCO3 không tan (K).
Ứng Dụng Của Hiểu Biết Về Độ Tan
Hiểu rõ về độ tan và “chất nào ít tan trong nước” có nhiều ứng dụng quan trọng trong thực tế, bao gồm:
- Hóa học phân tích: Sử dụng độ tan để tách các chất ra khỏi hỗn hợp.
- Dược phẩm: Độ tan ảnh hưởng đến khả năng hấp thụ thuốc của cơ thể.
- Môi trường: Hiểu biết về độ tan giúp dự đoán sự di chuyển của các chất ô nhiễm trong nước.
- Công nghiệp: Độ tan quan trọng trong nhiều quy trình sản xuất, ví dụ như sản xuất phân bón, hóa chất.
Hy vọng bài viết này đã cung cấp thông tin chi tiết và hữu ích về “chất nào ít tan trong nước” và các khía cạnh liên quan đến độ tan.