Bài toán đốt cháy hợp chất hữu cơ là một dạng bài tập quan trọng và thường gặp trong chương trình hóa học phổ thông và luyện thi đại học. Đặc biệt, bài toán đốt cháy hoàn toàn 0.33 mol hỗn hợp X gồm các este như metyl propionat, metyl axetat và các hidrocacbon mạch hở đòi hỏi sự kết hợp kiến thức về cấu tạo chất, phương trình phản ứng và kỹ năng giải toán hóa học. Dưới đây là phân tích chi tiết về cách giải quyết dạng bài tập này.
Để giải quyết các bài toán đốt cháy, ta cần nắm vững các kiến thức sau:
-
Công thức tổng quát của este và hidrocacbon:
- Este đơn chức, no, mạch hở có công thức CnH2nO2.
- Hidrocacbon no, mạch hở (ankan): CnH2n+2.
- Hidrocacbon không no, mạch hở (anken, ankin, ankadien,…): CnH2n+2-2k (k là số liên kết pi hoặc vòng).
-
Phương trình phản ứng đốt cháy tổng quát:
- CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2 H2O
-
Định luật bảo toàn nguyên tố và bảo toàn khối lượng: Đây là công cụ quan trọng để thiết lập các mối quan hệ giữa các chất trong phản ứng.
-
Kỹ năng biện luận và giải hệ phương trình: Thường xuyên sử dụng để tìm ra các ẩn số cần thiết.
Xét bài toán cụ thể: Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat (C4H8O2), metyl axetat (C3H6O2) và 2 hidrocacbon mạch hở cần vừa đủ 1,27 mol O2, tạo ra 14,4 gam H2O. Yêu cầu xác định số mol Br2 phản ứng tối đa khi cho 0,33 mol X vào dung dịch Br2 dư.
Lời giải chi tiết thường bao gồm các bước sau:
-
Xác định số mol của H2O: nH2O = 14,4/18 = 0,8 mol
-
Gọi công thức chung của 2 hidrocacbon: Giả sử công thức chung là CxHy.
-
Viết phương trình đốt cháy tổng quát cho hỗn hợp X:
- Phương trình đốt cháy tổng quát giúp ta thiết lập mối quan hệ giữa số mol các chất tham gia và sản phẩm.
-
Áp dụng định luật bảo toàn nguyên tố O:
- Số mol O trong X + 2*nO2 = 2*nCO2 + nH2O
- Từ đó, tính được nCO2.
-
Tính số mol CO2: Gọi số mol của metyl propionat là a, metyl axetat là b, và CxHy là c. Ta có: a + b + c = 0,33. Sử dụng các phương trình bảo toàn nguyên tố C và H để tìm mối liên hệ giữa a, b, c và số mol CO2, H2O.
-
Xác định độ không no trung bình của hidrocacbon:
- Độ không no (số liên kết π) trung bình của hidrocacbon được tính từ số mol Br2 phản ứng.
-
Tính số mol Br2 phản ứng: Số mol Br2 phản ứng tỉ lệ với số liên kết π trong hidrocacbon không no.
Ví dụ minh họa:
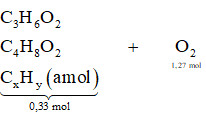
Alt: Sơ đồ phản ứng đốt cháy hoàn toàn hỗn hợp X, minh họa các chất tham gia và sản phẩm tạo thành.
Alt: Giải chi tiết bài toán đốt cháy hỗn hợp X, bao gồm các bước tính toán số mol và xác định công thức cấu tạo.
Lưu ý: Để giải nhanh các bài toán loại này, cần rèn luyện kỹ năng nhìn nhanh, phân tích và áp dụng các định luật một cách linh hoạt.
Hi vọng với những phân tích trên, bạn đọc có thể hiểu rõ hơn về cách giải quyết các bài toán liên quan đến đốt cháy hoàn toàn 0.33 mol hỗn hợp X và áp dụng chúng vào các bài tập tương tự.
